阿尔茨海默病的“致命组合”?
作者: aeks | 发布时间: 2025-10-22 23:39 | 更新时间: 2025-10-22 23:39
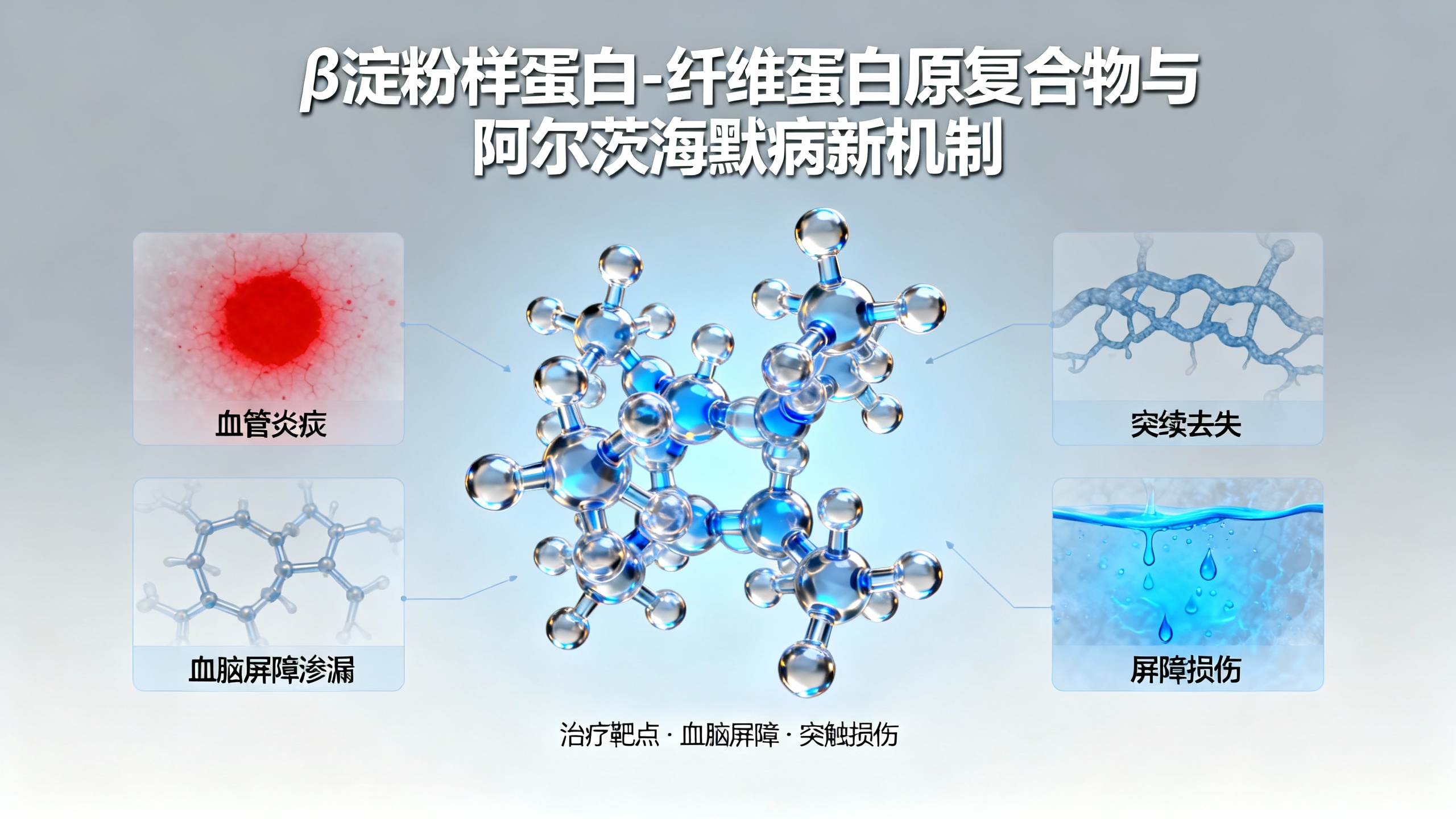
β淀粉样蛋白与血液蛋白的毒性相互作用 新研究揭示了两种关键分子之间的有害关联:以形成斑块闻名的β淀粉样蛋白(Aβ)和参与凝血的主要血液蛋白纤维蛋白原。当Aβ与纤维蛋白原结合时,会产生难以分解的异常凝块。这些顽固凝块与血管炎症和损伤相关,即使极少量的这种复合物似乎也会引发阿尔茨海默病的早期迹象,包括突触丢失、脑部肿胀和血脑屏障渗漏。该结果进一步证实血管功能障碍直接导致神经退行性病变,并凸显了一个极具前景的新治疗靶点:Aβ/纤维蛋白原复合物。
洛克菲勒大学西德尼·斯特里克兰德实验室的副研究教授艾琳·诺里斯表示:“在阿尔茨海默病患者脑中,单独的Aβ或纤维蛋白原需要大量才能造成严重损害。但当两者形成复合物时,只需极少量的每种物质就会引发损伤。Aβ和纤维蛋白原之间存在协同效应。”
验证长期假说 斯特里克兰德的帕特里夏和约翰·罗森沃尔德神经生物学与遗传学实验室对这种Aβ/纤维蛋白原关联的研究已近二十年。该团队早期研究表明,Aβ会与纤维蛋白原结合,且这种相互作用与阿尔茨海默病的进展相关。当时,血管问题可能在阿尔茨海默病中起重要作用的观点颇具争议。诺里斯说:“直到最近,随着该领域的多项突破,人们才开始相信血管系统参与阿尔茨海默病的发病机制。自我们最初的发现以来,我们一直专注于研究解释血管系统功能障碍如何影响阿尔茨海默病的机制。”
识别该复合物只是开始。研究人员想知道它本身能造成多大损害。他们在实验室中制备了低浓度的Aβ/纤维蛋白原复合物,并将其应用于小鼠脑组织切片和活体小鼠。这样他们就能在严格控制的条件下观察其作用。
副研究员ELISA·尼科洛索·西芒斯-皮雷斯说:“我们想真正展示这种损害——深入观察突触前和突触后末梢究竟是如何受损的。”
他们的实验表明,虽然单独的Aβ和纤维蛋白原几乎不会造成伤害,但即使少量的这种复合复合物也会引发严重问题。它会损伤突触、加剧炎症并破坏血脑屏障——这些都是阿尔茨海默病的典型特征。当研究人员使用阻止Aβ与纤维蛋白原结合的抗体时,有害影响显著降低。
西芒斯-皮雷斯说:“我们发现,这种复合物确实会导致血脑屏障渗漏,而单独的蛋白质则不会。血脑屏障被破坏后,血液蛋白会渗入大脑,从而造成额外伤害。”
阿尔茨海默病早期线索与潜在治疗方法 该研究的一个优势在于它同时使用了离体脑组织和活体小鼠。诺里斯说:“这是一项体外和体内研究,两者都得出了相同的结果。当我们能在培养物和活体生物中都观察到相同现象时,我们对结果更有信心。”接下来,该团队计划探索其机制——为什么这种复合物会造成如此大的麻烦?
这也可能具有临床意义,因为研究表明,即使少量的Aβ/纤维蛋白原复合物也能在认知症状出现前很久就引发阿尔茨海默病的特征。例如,接触该复合物的小鼠体内磷酸化tau181水平也升高了,这是一种用于在人类症状出现前数年检测阿尔茨海默病的生物标志物。这一结果表明,当前研究可能模拟了阿尔茨海默病进展的最早阶段,针对该复合物本身的早期干预可能会延缓或预防该病。
尽管阿尔茨海默病的发病机制众多,但该团队认为这一特定途径值得更多关注。西芒斯-皮雷斯说:“这不是一种简单的疾病。许多其他因素也会诱发神经毒性,我们当然不认为抑制这种复合物的形成就能治愈阿尔茨海默病。但或许靶向这种复合物可以缓解部分病理变化,与其他疗法结合使用可能更有效。”这些发现使研究人员在理解阿尔茨海默病患者脑中损伤如何扩散以及阻止单一毒性相互作用如何发挥作用方面又迈进了一步。
DOI: 10.1002/alz.70119