这种微小的分子“妙招”,让蜘蛛丝几乎扯不断
作者: aeks | 发布时间: 2026-02-08 03:04 | 更新时间: 2026-02-08 03:04
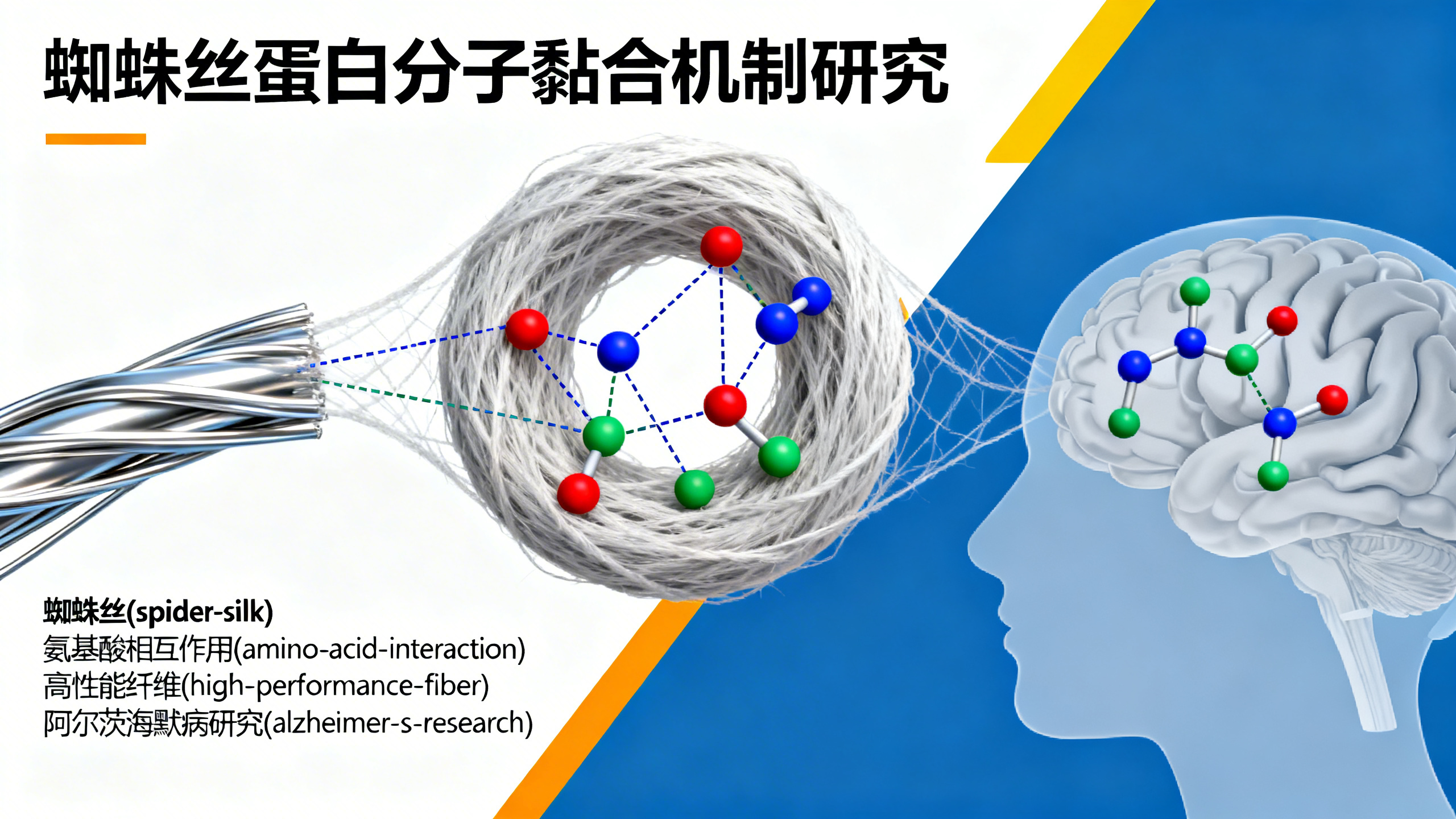
伦敦国王学院与圣地亚哥州立大学的科学家在《美国国家科学院院刊》发表研究,阐述了可能指导新一代高性能环保纤维研发的基本设计原理。重要的是,该研究首次解释了蜘蛛丝蛋白中的氨基酸如何相互作用,像分子“黏合剂”一样在纤维形成时将材料凝聚在一起。伦敦国王学院计算材料科学教授、英国研究团队负责人克里斯·洛伦茨强调了研究结果的广泛潜力:“潜在应用非常广泛——轻量化防护服、飞机部件、可生物降解医疗植入物,甚至软机器人都能从运用这些自然原理设计的纤维中受益。”
蜘蛛丝为何比钢还强
蜘蛛的牵引丝以其卓越性能著称,同等重量下比钢更坚固,比用于制造防弹背心的凯夫拉纤维更坚韧。蜘蛛依靠这种材料构建蛛网的结构框架并悬挂自身,科学家长期以来对大自然如何产生这种特殊纤维充满好奇。
这种丝在蜘蛛的丝腺内生成,丝蛋白以名为“丝蛋白原液”的浓稠液体形式储存。需要时,蜘蛛将这种液体纺成具有非凡力学性能的固体纤维。科学家已知道,蛋白质在被拉成纤维前会先聚集成液滴状,但从这种早期聚集到最终丝强度之间的分子步骤一直是个谜。
丝形成背后的分子相互作用
为解开这个谜题,由化学家、生物物理学家和工程师组成的跨学科团队运用了一系列先进的计算和实验室技术,包括分子动力学模拟、AlphaFold3结构建模和核磁共振光谱学。
他们的分析发现,精氨酸和酪氨酸这两种氨基酸通过特定方式相互作用,导致丝蛋白在最早期阶段就聚集在一起。这些相互作用在丝固化过程中不会消失,而是在纤维形成时持续发挥作用,帮助构建出赋予蜘蛛丝卓越强度和柔韧性的复杂纳米结构。洛伦茨表示:“这项研究从原子层面解释了无序蛋白质如何组装成高度有序的高性能结构。”
与脑科学和阿尔茨海默病研究的联系
圣地亚哥州立大学物理与分析化学教授、美国研究团队负责人格雷戈里·霍兰德称,这一过程的化学复杂性出乎意料。“让我们惊讶的是,通常被认为是美丽简单天然纤维的蜘蛛丝,实际上依赖于非常复杂的分子技巧,”霍兰德说,“我们发现的这类相互作用也存在于神经递质受体和激素信号传导中。”
由于这种重叠,研究人员认为这些发现的意义可能超出材料科学领域。“丝蛋白经历相分离然后形成富含β-折叠结构的过程,与阿尔茨海默病等神经退行性疾病中的机制相似,”霍兰德说,“研究蜘蛛丝为我们提供了一个纯净、经过进化优化的系统,以理解如何控制相分离和β-折叠结构的形成。”