衰老导致大脑免疫细胞积累难以降解的突触蛋白
作者: aeks | 发布时间: 2026-01-22 15:01 | 更新时间: 2026-01-22 15:01
学科分类: 生物医学工程
衰老会伴随蛋白质稳态(即维持蛋白质组平衡与功能的能力)的丧失,这在大脑中会增加认知和运动能力下降及神经退行性疾病的易感性。为深入理解神经元特异性的蛋白质稳态动态,研究人员开发了生物正交非天然氨基酸标记(BONCAT)工具,包括PheRS*和TyrRS*基因敲入小鼠模型,并通过与Camk2a-cre驱动子杂交,实现了对新生神经元蛋白质组的特异性标记。
研究首先验证了这些模型的标记效果,发现Camk2a-cre;PheRS*模型在神经元中的标记效率最高,能标记3787种蛋白质,且不会诱导应激反应或小胶质细胞活化。通过对运动皮层、纹状体和海马等脑区的分析,发现不同脑区的神经元蛋白质组存在区域特异性。
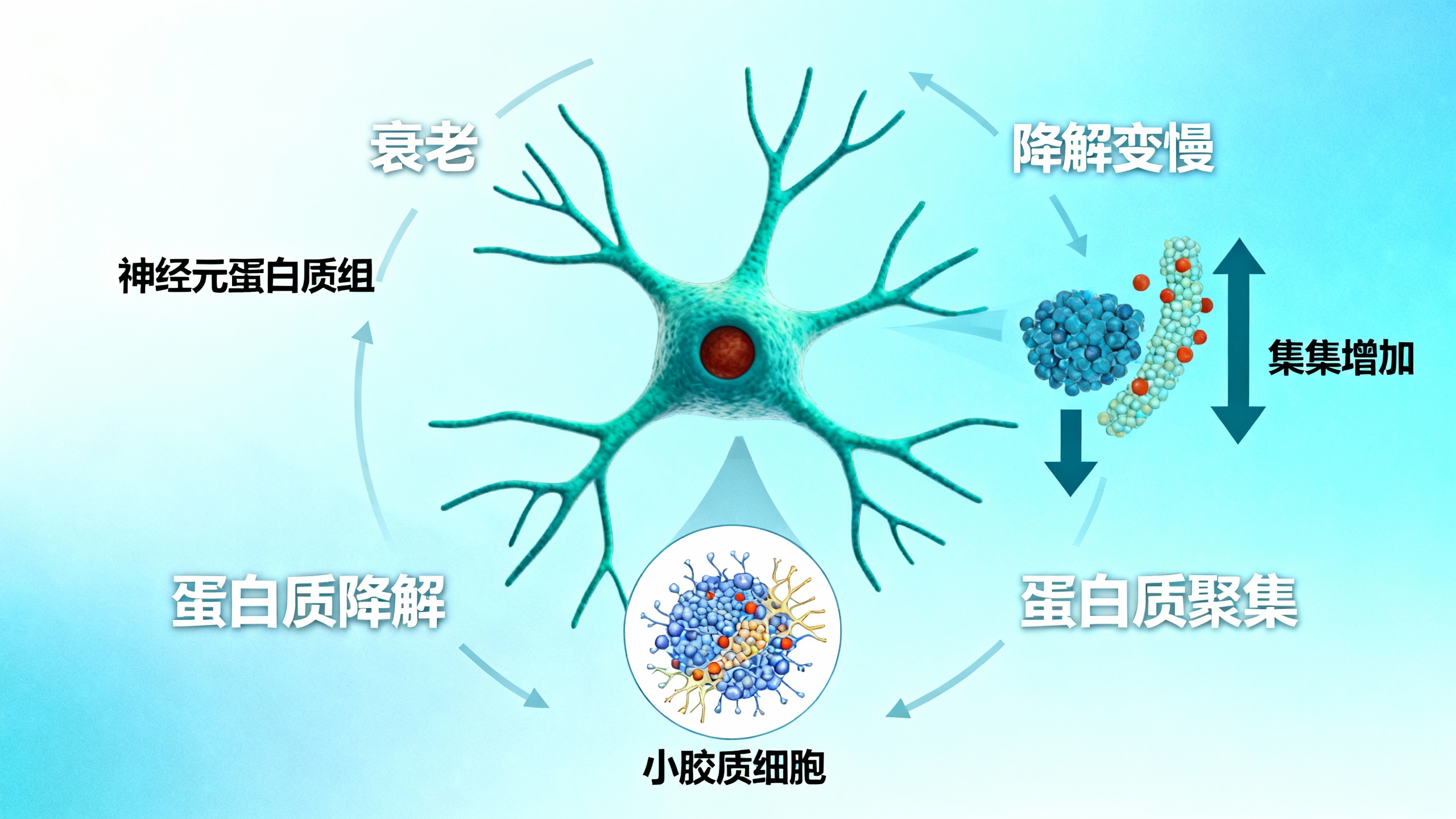
进一步研究衰老对神经元蛋白质降解的影响,使用AAV载体在年轻(4月龄)、中年(12月龄)和老年(24月龄)小鼠中表达PheRS*,结合脉冲追踪实验和质谱分析,发现神经元蛋白质降解速率随衰老显著减慢,平均半衰期从4月龄到24月龄约翻倍,且不同脑区的变化存在差异,这种减慢主要在中年后显现。
研究还鉴定出老年小鼠神经元的“聚集蛋白质组”(aggregome),包含1726种蛋白质,其中近一半随衰老降解减少。这些聚集蛋白中,既有已知的神经退行性疾病相关蛋白,也有许多新发现的蛋白,且69%由疾病风险基因编码,突触相关蛋白尤为富集。
此外,发现老年小胶质细胞会积累神经元来源的蛋白质,其中54%同时存在降解减少和/或聚集现象,突触蛋白占比很高。这些蛋白质可能通过分泌或小胶质细胞吞噬突触等方式转移,且54.3%定位于小胶质细胞的溶酶体中,表明小胶质细胞可能参与这些异常蛋白的降解。
综上,研究揭示了衰老导致神经元蛋白质稳态显著丧失,突触蛋白的降解减慢和聚集可能通过小胶质细胞的处理形成级联反应,这可能是年龄相关突触丢失和认知下降的原因。