过度激活LIGHT信号并阻断免疫检查点可改变肝脏转移性肠癌的免疫环境
作者: aeks | 发布时间: 2025-10-15 23:28 | 更新时间: 2025-10-15 23:28
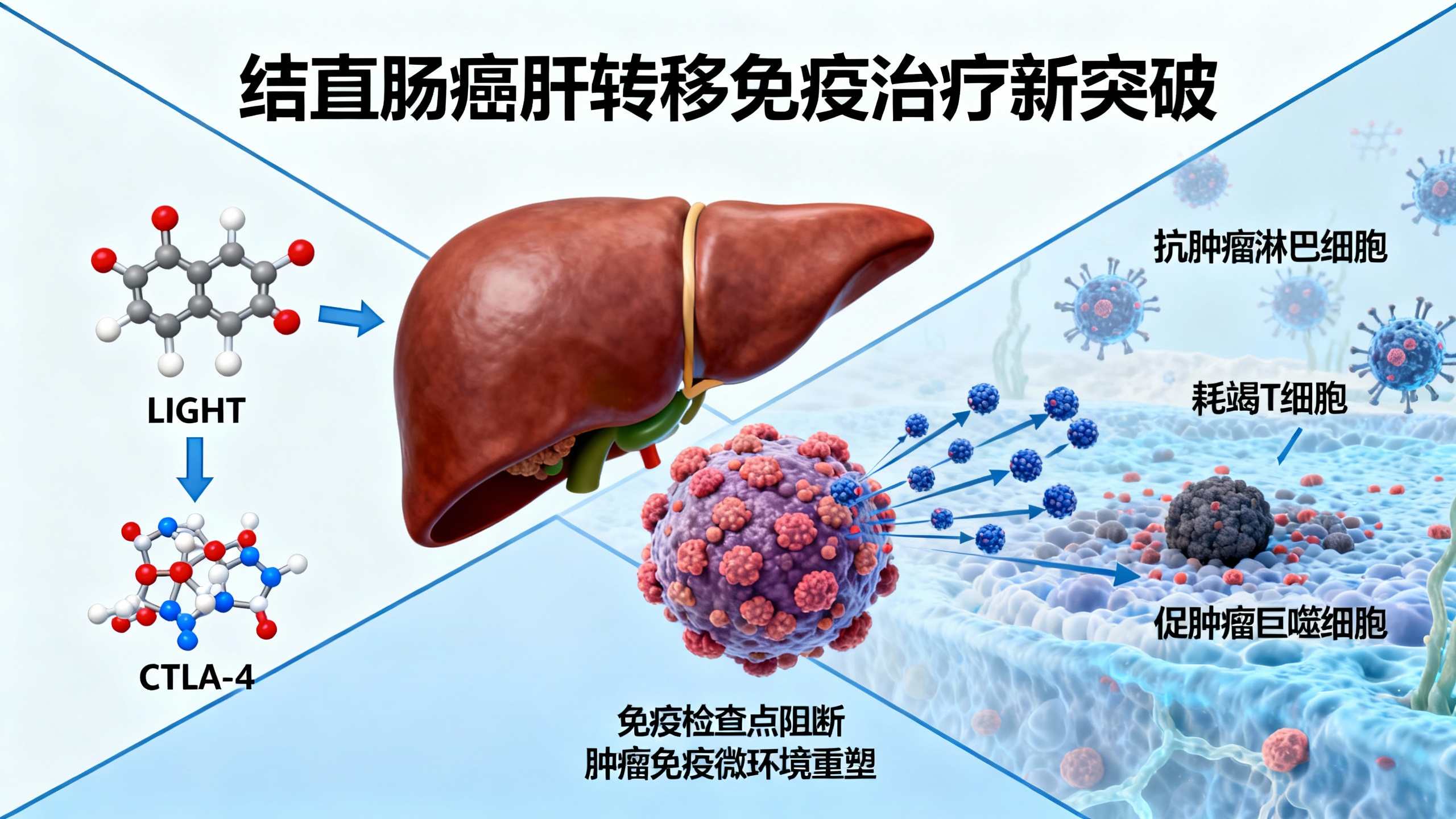
结直肠癌(CRC)是全球第三大常见新发癌症,也是美国癌症相关死亡的第二大原因。肝脏是结直肠癌最常见的转移部位,约50%的患者会出现肝转移,即便手术切除后长期生存率仍较低。免疫检查点阻断(ICB)在黑色素瘤等癌症中展现出突破性疗效,但在占结直肠癌95%以上的微卫星稳定型(MSS)患者中效果甚微,这类肿瘤新抗原负荷低,对单药或联合ICB治疗反应差。此外,当存在肝转移时,ICB响应率进一步降低,因此亟需开发能克服MSS结直肠癌转移癌治疗抵抗的新型免疫联合疗法。
LIGHT(TNFSF14)是一种免疫刺激性细胞因子,可激活CD8+ T细胞、增强抗肿瘤免疫应答并克服基质抗原屏障。此前研究发现,结直肠癌肝转移(CRLM)患者肿瘤微环境中LIGHT表达升高与T细胞增殖活化增加、总生存期及无复发生存期改善相关。在MSS免疫competent结直肠癌肝转移小鼠模型中,LIGHT过表达可部分突破免疫抑制阈值,驱动以CD8+ T细胞为主的抗肿瘤免疫应答,但单药治疗仍存在未明确的抑制信号,无法实现肿瘤完全消退,推测可能与T细胞耗竭及免疫抑制性成分招募有关。鉴于结直肠癌肝转移中CTLA-4+肿瘤浸润淋巴细胞(TILs)富集,研究团队提出联合LIGHT过表达与抗CTLA-4治疗的策略,并探讨其作用机制与临床潜力。
研究结果显示,在CT26(MSS型)结直肠癌肝转移小鼠模型中,LIGHT过表达联合抗CTLA-4治疗组的肝转移瘤负荷显著低于LIGHT单药组、抗CTLA-4单药组及对照组,多数肝脏无可见转移灶。流式细胞术分析表明,联合治疗重塑了肿瘤免疫微环境:肿瘤内CD45+细胞、CD3+ T细胞、CD8+ T细胞比例增加,G-MDSCs和巨噬细胞比例降低;脾脏中CD3+、CD4+、CD8+ T细胞及NK细胞扩增,CD11c+树突状细胞(DC)增多。而联合抗PD-1并未进一步增强疗效,提示该联合效应具有CTLA-4特异性。在MC38(MSI-H型)结直肠癌肝转移模型及人源化HT-29(MSS型)肿瘤小鼠模型中,联合治疗也显示出类似的抗肿瘤效果,包括肿瘤退缩及T细胞浸润增加。
机制研究发现,联合治疗通过多种途径增强抗肿瘤免疫:一是促进TILs向肝转移灶归巢,免疫荧光及质谱流式(CyTOF)显示肿瘤界面CD3+ T细胞浸润增加,肿瘤组织中Madcam1、Ccl21等趋化因子表达上调,促进T细胞迁移及三级淋巴结构(TLSs)形成;二是增强T细胞活化与效应功能,单细胞RNA测序(scRNA-seq)显示CD8+ T细胞中Ifng等效应因子基因表达上调,CyTOF及流式证实CD8+ T细胞IFN-γ、颗粒酶B表达增加,效应记忆T细胞(CD44+CD62L-)比例升高,同时T细胞耗竭标志物(Pdcd1、Lag3、Tigit等)表达降低;三是抑制Treg功能,尽管Treg比例未显著降低,但联合治疗下调Treg中Pdcd1、Il10等抑制性基因表达,降低颗粒酶B水平,体外实验显示其抑制Teff细胞增殖的能力减弱;四是减少免疫抑制性髓系细胞,scRNA-seq表明联合治疗可清除LIGHT单药或抗CTLA-4单药诱导的Arg1+、C1qa+促肿瘤巨噬细胞及Mmp9+Vegfa+ G-MDSCs,同时促进cDC成熟,CD86+、CD80+ cDC比例增加;五是增加T细胞克隆多样性,TCR测序显示联合治疗诱导T细胞克隆扩增,且识别的肿瘤抗原谱更广。
临床相关性方面,TCGA数据库396例结直肠癌样本分析显示,高LIGHT表达肿瘤T细胞耗竭评分更高,而高LIGHT+高CTLA-4表达肿瘤耗竭评分显著高于高LIGHT+低CTLA-4组,提示联合抗CTLA-4可缓解LIGHT诱导的T细胞耗竭,与动物实验结果一致。
综上,LIGHT过表达联合抗CTLA-4通过协同招募并活化T细胞、逆转T细胞耗竭、清除免疫抑制性髓系细胞,有效控制MSS结直肠癌肝转移,为免疫“冷肿瘤”及肝转移癌的治疗提供了新策略,具有重要临床转化价值。