长寿弓头鲸DNA修复能力更强的证据
作者: aeks | 发布时间: 2025-11-15 12:03 | 更新时间: 2025-11-15 12:03
阿拉斯加因纽皮亚克人有着捕猎弓头鲸的悠久传统,他们认为这种大型须鲸能“活两辈子”。后续科学研究通过卵巢 corpus 量化、鲸须年代测定和晶状体天冬氨酸外消旋分析等方法,证实弓头鲸的最大寿命超过200年。哺乳动物的寿命差异巨大,模式生物小鼠仅能活2-3年,而弓头鲸的寿命是其100倍,体重还可超过8万公斤。通常,寿命长、体型大的生物会积累更多DNA突变,但体型较大的物种癌症发病率并未随之升高,这种现象被称为“佩托悖论”。弓头鲸能存活如此之久,必然拥有独特的遗传机制来预防癌症和其他与年龄相关的疾病,然而关于其衰老的遗传和分子机制研究较少,主要集中在基因组和转录组分析。
致癌过程的多阶段模型认为,正常细胞转变为癌细胞需要多个不同的遗传“打击”(突变)。体型更大、寿命更长的物种可能需要更多突变才能发生致癌转化。例如,小鼠成纤维细胞需要扰动两个通路(p53和Ras)即可发生致瘤转化,而人类成纤维细胞则需要五个突变(p53、RB、PP2A、端粒酶和Ras)。按理说,弓头鲸这类更大型、更长寿的物种应该比人类有更多防癌机制。大象等物种通过增加TP53等抑癌基因的拷贝数和功能多样化来增强对基因毒性应激的凋亡反应,从而更有效地清除受损细胞,但增强凋亡可能无法延缓衰老。而增强DNA修复和维持基因组稳定性,可能是解释长寿哺乳动物抗癌和衰老缓慢的潜在机制,多个研究也指出DNA修复能力的提高和突变积累的减少与物种长寿相关。
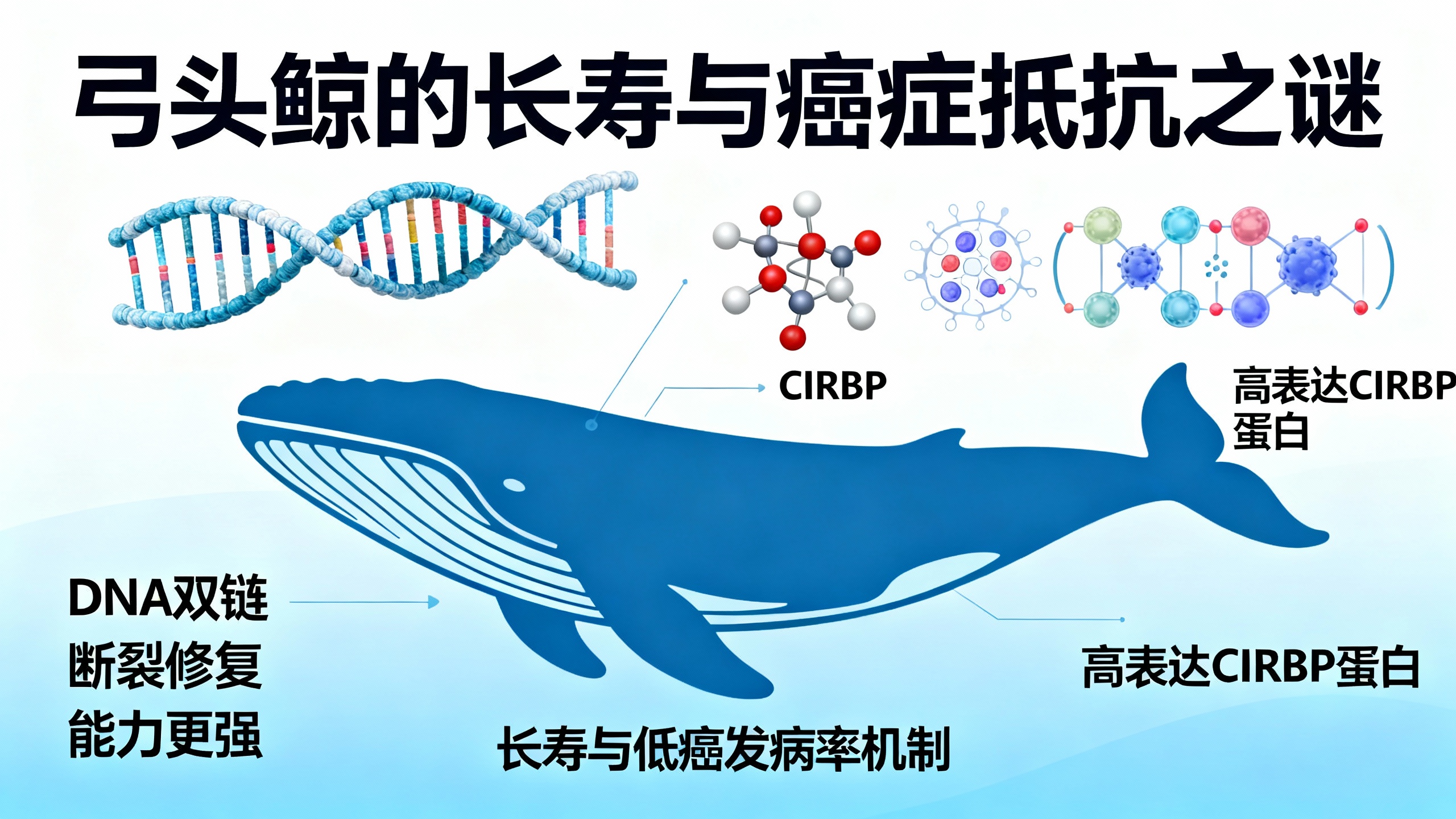
本研究通过对弓头鲸成纤维细胞和组织的实验,发现其细胞凋亡并未增强,发生恶性转化所需的遗传突变也不比人类细胞多,反而更少。但弓头鲸细胞表现出更强的错配修复和DNA双链断裂(DSB)修复能力,包括非同源末端连接(NHEJ)和同源重组(HR)效率更高, baseline的DSB负担更低,遭受博来霉素等损伤后能更快修复损伤灶,对损伤药物的抗性更强,微核形成减少。这些能力有助于减少突变、结构变异和染色体不稳定。
研究还发现,一种名为冷诱导RNA结合蛋白(CIRBP)的蛋白质在弓头鲸成纤维细胞和组织中高表达,而在其他哺乳动物(除座头鲸和海豚有少量表达外)中几乎检测不到。弓头鲸的CIRBP能增强人类细胞的NHEJ和HR修复,减少微核形成,保护DNA末端并促进体外末端连接。其高表达可能通过液-液相分离等方式聚集修复因子、稳定DNA末端。在果蝇中过表达CIRBP能延长寿命并提高对辐射的抗性。
综上,弓头鲸并非依赖额外的抑癌基因来预防癌症,而是通过增强DNA修复来维持基因组完整性。这种不轻易清除受损细胞而是忠实修复它们的“保守”策略,可能正是其异常长寿和低癌症发病率的原因。这一发现为人类开发基于增强DNA修复的癌症预防和抗衰老疗法提供了新方向。