外泌体:涡虫体内干细胞通信与全身RNA干扰的“信使”
作者: aeks | 发布时间: 2026-02-15 00:02 | 更新时间: 2026-02-15 00:02
学科分类: 生物医学工程
再生是生物在创伤(如截肢、炎症)后修复受损组织的复杂过程。动物的再生能力差异很大,从仅能愈合伤口到可完全再生身体部位不等。细胞分泌的“分泌组”包括可溶性成分(如蛋白质、生长因子)和囊泡成分,其中细胞外囊泡(EVs)是膜包裹的纳米颗粒,在细胞通讯中起重要作用,但其在再生中的具体功能尚不明确。涡虫具有极强的再生能力,能在截肢后7天内再生缺失组织,是研究再生的理想模型。本研究旨在探究EVs在涡虫再生中的作用。
研究首先发现涡虫干细胞和成虫均可分泌EVs。通过电镜观察和分子分析,这些EVs大小在50-200纳米,表面有CD9、CD63等典型EV标记蛋白,其生成方式、形态和蛋白质组成与其他生物的EVs相似。环境压力(如低温、持续光照)会显著增加EV的释放量,表明涡虫可根据环境动态调节EV生成。
接着,研究鉴定出32个涡虫EV生成相关基因,这些基因与其他生物中调控EV生成的ESCRT(内体分选复合物)通路基因同源,说明EV生成机制在进化上是保守的。通过RNA干扰(RNAi)敲低这些基因,发现其中11个基因的缺失会导致涡虫出现上皮破裂、头部退化等组织稳态缺陷,且EV产量也发生改变,表明EV生成对涡虫的正常生理和再生至关重要。
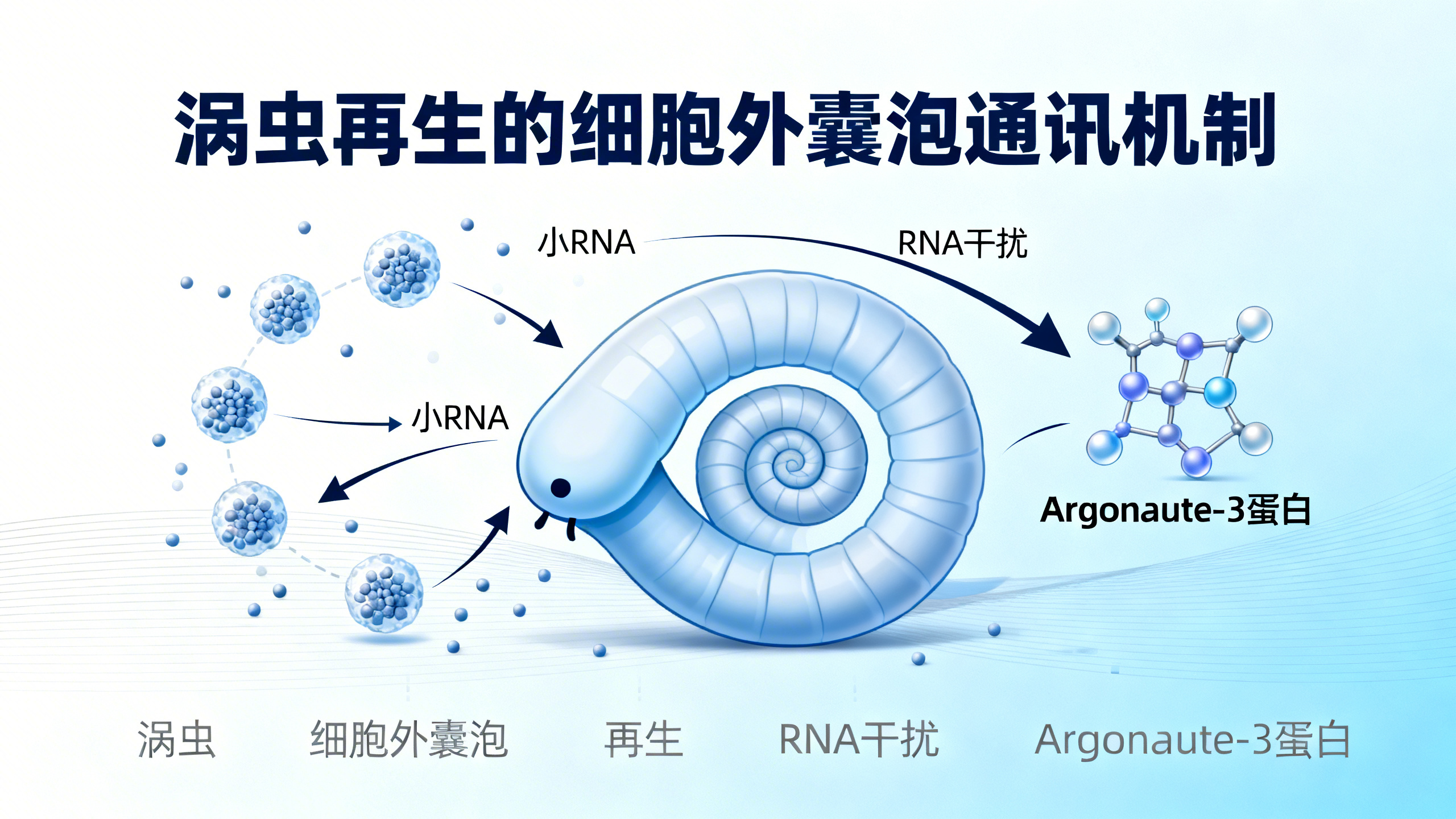
蛋白质组学和小RNA分析显示,涡虫EVs携带丰富的生物分子。小EVs富含转运相关蛋白和典型EV标记(如四跨膜蛋白、 flotillin1),大EVs则富集细胞骨架相关蛋白(如肌动蛋白)。EVs中还含有多种小RNA,包括microRNA(miRNA)、Piwi相互作用RNA(piRNA)和tRNA衍生小RNA(tsiRNA),且头部再生和尾部再生的涡虫EVs中,小RNA组成存在差异,提示EVs可能参与区域特异性再生过程。
功能研究发现,EVs是涡虫全身性RNAi的关键介质。喂食双链RNA(dsRNA)后,涡虫EV产量显著增加,且EVs中存在dsRNA衍生的小干扰RNA(siRNA)。将这些EVs移植到健康涡虫体内,能诱导目标基因沉默,产生与直接RNAi处理相同的表型(如眼缺失、前后轴异常)。进一步研究表明,Argonaute家族蛋白AGO-3在siRNA装载到EVs中起关键作用:敲低AGO-3会减少EVs中的siRNA含量,从而阻断全身性RNAi效应。
此外,涡虫干细胞能摄取EVs。将带有piwi-1基因siRNA的EVs与干细胞共培养,可显著降低干细胞中piwi-1的表达,证明EVs能将功能性RNA递送到靶细胞。
总之,本研究揭示了EVs在涡虫细胞通讯和再生中的核心作用:它们作为“分子快递”,携带小RNA等信号分子,在AGO-3的协助下实现细胞间信息传递,调控基因表达和组织再生。这一发现不仅为理解涡虫的超强再生能力提供了新视角,也为探索其他动物(包括人类)的组织修复机制提供了重要参考。
标签: Argonaute-3蛋白 RNA干扰 再生 涡虫 细胞外囊泡