麻省理工科学家揭开癌细胞的“糖衣”保护罩
作者: aeks | 发布时间: 2025-12-24 03:02 | 更新时间: 2025-12-24 03:02
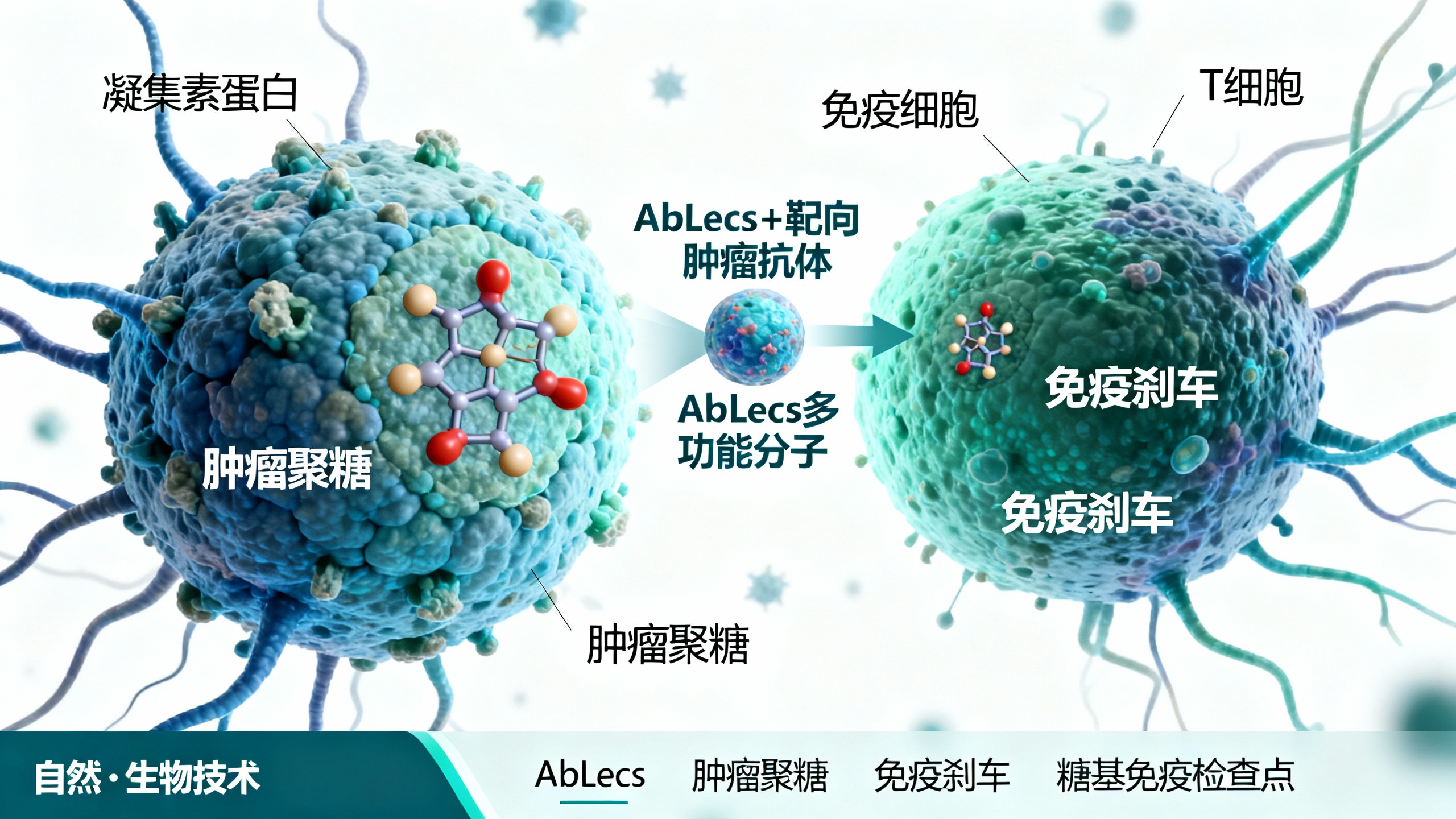
这项研究的核心是找到一种方法来解除肿瘤触发的“内置刹车”,这种刹车会阻止免疫细胞攻击肿瘤。该刹车与癌细胞表面一种名为聚糖的糖分子有关。科学家发现,用名为凝集素的蛋白质阻断这些聚糖,能极大增强对抗癌细胞的免疫活性。为实现靶向阻断,他们研发出一种名为AbLecs的多功能分子,将凝集素与能靶向肿瘤的抗体结合。
生物工程系与化学工程系的安德伍德-普雷斯科特职业发展教授杰西卡·斯塔克(Jessica Stark)表示:“我们研发出一种新型蛋白疗法,能阻断糖基免疫检查点,增强抗癌免疫反应。由于已知聚糖会在多种肿瘤中抑制对癌症的免疫反应,我们推测这些分子或能为许多癌症患者提供新的、可能更有效的治疗选择。”斯塔克同时也是麻省理工学院科赫综合癌症研究所成员,作为论文第一作者领导了该研究。斯坦福大学化学教授、萨拉凡化学与人类健康研究所(Sarafan ChEM-H Institute)所长卡罗琳·贝尔托齐(Carolyn Bertozzi)担任资深作者。研究成果发表于《自然·生物技术》(Nature Biotechnology)。
癌症如何利用免疫刹车
癌症治疗的一大目标是让免疫系统识别并清除肿瘤细胞。一类名为检查点抑制剂的主要免疫治疗药物通过阻断PD-1和PD-L1两种蛋白质的相互作用发挥作用。通过阻断这种连接,这些药物能解除肿瘤用来阻止T细胞等免疫细胞杀死癌细胞的刹车。
靶向PD-1/PD-L1通路的检查点抑制剂已被批准用于多种癌症。对部分患者,它们能带来长期缓解;但对许多其他患者,却收效甚微或毫无益处。由于这一差距,研究人员正在寻找肿瘤抑制免疫系统的其他方式。一个有前景的靶点涉及肿瘤聚糖与免疫细胞受体之间的相互作用。
Siglecs、唾液酸与糖基检查点
聚糖存在于几乎所有活细胞表面,但癌细胞常携带健康细胞上没有的特殊聚糖。许多这类肿瘤特异性聚糖包含一种名为唾液酸的糖结构单元。当唾液酸附着在免疫细胞的凝集素受体上时,会开启免疫抑制通路。识别唾液酸的凝集素被称为Siglecs。
斯塔克说:“当免疫细胞上的Siglecs与癌细胞上的唾液酸结合时,会启动免疫抑制,阻止免疫细胞激活以攻击和破坏癌细胞,这与PD-1和PD-L1结合时的情况类似。”
尽管已探索多种方法,但目前尚无获批药物直接靶向Siglec-唾液酸相互作用。一种思路是研发能结合唾液酸并阻断其与免疫细胞接触的凝集素,但由于凝集素通常结合力不强,难以在癌细胞表面大量聚集,这一方法一直面临挑战。
AbLecs:抗体与凝集素的结合
为解决这一问题,斯塔克团队将抗体用作递送载体,将更多凝集素带到肿瘤处。抗体部分靶向癌细胞,到达后,附着的凝集素能结合唾液酸,阻断唾液酸与免疫细胞上的Siglec受体结合,从而解除免疫刹车,让巨噬细胞和自然杀伤(NK)细胞等免疫细胞攻击肿瘤。
斯塔克表示:“这种凝集素结合域通常亲和力较低,因此无法单独作为治疗剂。但当凝集素域与高亲和力抗体连接后,就能被带到癌细胞表面,从而结合并阻断唾液酸。”
细胞与小鼠实验中的“即插即用”设计
在本研究中,研究人员利用曲妥珠单抗(一种靶向HER2的抗体,已获批用于治疗乳腺癌、胃癌和结直肠癌)构建了AbLec。为制造AbLec,他们将抗体的一个臂替换为凝集素,选用了Siglec-7或Siglec-9。
细胞培养实验显示,这种AbLec能改变免疫细胞行为,促使其攻击并杀死癌细胞。团队还在经基因工程改造表达人类Siglec受体和人类抗体受体的小鼠中测试了AbLecs。给小鼠接种形成肺转移的癌细胞后,AbLec治疗组的肺转移灶数量少于单独使用曲妥珠单抗组。
研究人员还证明该方法具有灵活性:可替换不同的肿瘤靶向抗体,如靶向CD20的利妥昔单抗或靶向EGFR的西妥昔单抗;也可更换凝集素部分以靶向其他免疫抑制聚糖,或使用靶向PD-1等检查点蛋白的抗体。
斯塔克说:“AbLecs真正实现了即插即用,具有模块化特点。可以想象,更换不同的‘诱饵受体域’可靶向凝集素受体家族的不同成员,也可更换抗体臂。这很重要,因为不同癌症类型表达不同抗原,可通过改变抗体靶点来应对。”
后续计划与资金支持
斯塔克、贝尔托齐及其同事已成立Valora Therapeutics公司,以开发AbLecs候选药物,目标在未来2-3年内启动临床试验。
本研究资金部分来自伯勒斯·韦尔科姆基金科学界面职业奖、癌症免疫治疗学会史蒂文·A·罗森伯格学者奖、V基金会V学者grant、美国国家癌症研究所、美国国家普通医学科学研究所、默克发现生物制剂SEEDS grant、美国癌症协会博士后奖学金以及萨拉凡化学与人类健康研究所界面博士后种子基金。