神秘RNA揭示癌症的“隐藏层面”
作者: aeks | 发布时间: 2026-02-17 21:03 | 更新时间: 2026-02-17 21:03
学科分类: 临床医学 生物医学工程 生物工程 计算机科学与技术
在我们新发表的研究中,我们阐述了这项工作的进展过程:从分析大型癌症基因组数据集,到开发机器学习模型,再到在小鼠身上进行大规模功能实验,最终利用血液样本在近200名乳腺癌患者中证实了这些RNA的临床相关性。
**癌特异性oncRNAs广泛存在**
我们的首个重要发现之一是,这种现象不仅限于乳腺癌。通过分析癌症基因组图谱(TCGA)中32种不同癌症类型的小RNA测序数据,我们识别出约26万个癌特异性小RNA。我们将这些分子称为癌RNA(oncRNAs),它们存在于所分析的每一种癌症类型中。
它们的分布并非随机。每种癌症类型都有其独特的oncRNA表达模式。例如,肺癌与乳腺癌的oncRNA组合不同。利用这些模式,机器学习模型对癌症类型的分类准确率达到90.9%;在另一组938个肿瘤样本的测试中,分类准确率仍高达82.1%。
同一癌症内部也存在差异。基底型乳腺癌肿瘤的oncRNA模式与管腔型肿瘤不同,这表明可能存在尚未完全明确的其他亚型。这些发现表明,oncRNAs反映了癌细胞状态的基本特征。oncRNAs的存在与缺失模式就像“数字分子条形码”,能在多个层面(包括肿瘤类型、亚型和细胞状态)捕捉癌症的特性。
**部分oncRNAs主动驱动肿瘤生长**
尽管oncRNAs是强大的生物标志物,但我们还想了解其中是否有一些会直接影响癌症进展。具体来说,我们想知道癌细胞是否能利用这些新出现的RNA分子来激活致癌通路。
为验证这一点,我们构建了包含约400个来自乳腺、结肠、肺和前列腺肿瘤的oncRNAs筛选库。通过慢病毒载体将这些RNA导入癌细胞:一半情况下增加oncRNA的表达,另一半则使用“Tough Decoy(强力诱饵)”构建体降低其表达。然后将改造后的细胞植入小鼠体内,以确定哪些oncRNAs会促进肿瘤生长。
在异种移植小鼠模型中,约5%的oncRNAs产生了明显的生物学效应。我们对两种乳腺癌oncRNAs进行了深入研究:一种会触发上皮-间质转化(癌症进展和转移的关键步骤),另一种会激活E2F靶基因以促进细胞增殖。在独立的细胞系模型中,两者都显著加速了肿瘤生长并增加了转移定植。
分析患者肿瘤数据时,我们发现表达这些oncRNAs的肿瘤也显示出类似的通路变化。在TCGA样本和实验模型中观察到一致的生物学模式,增强了我们对研究结果的信心。
**癌细胞将oncRNAs释放到血液中**
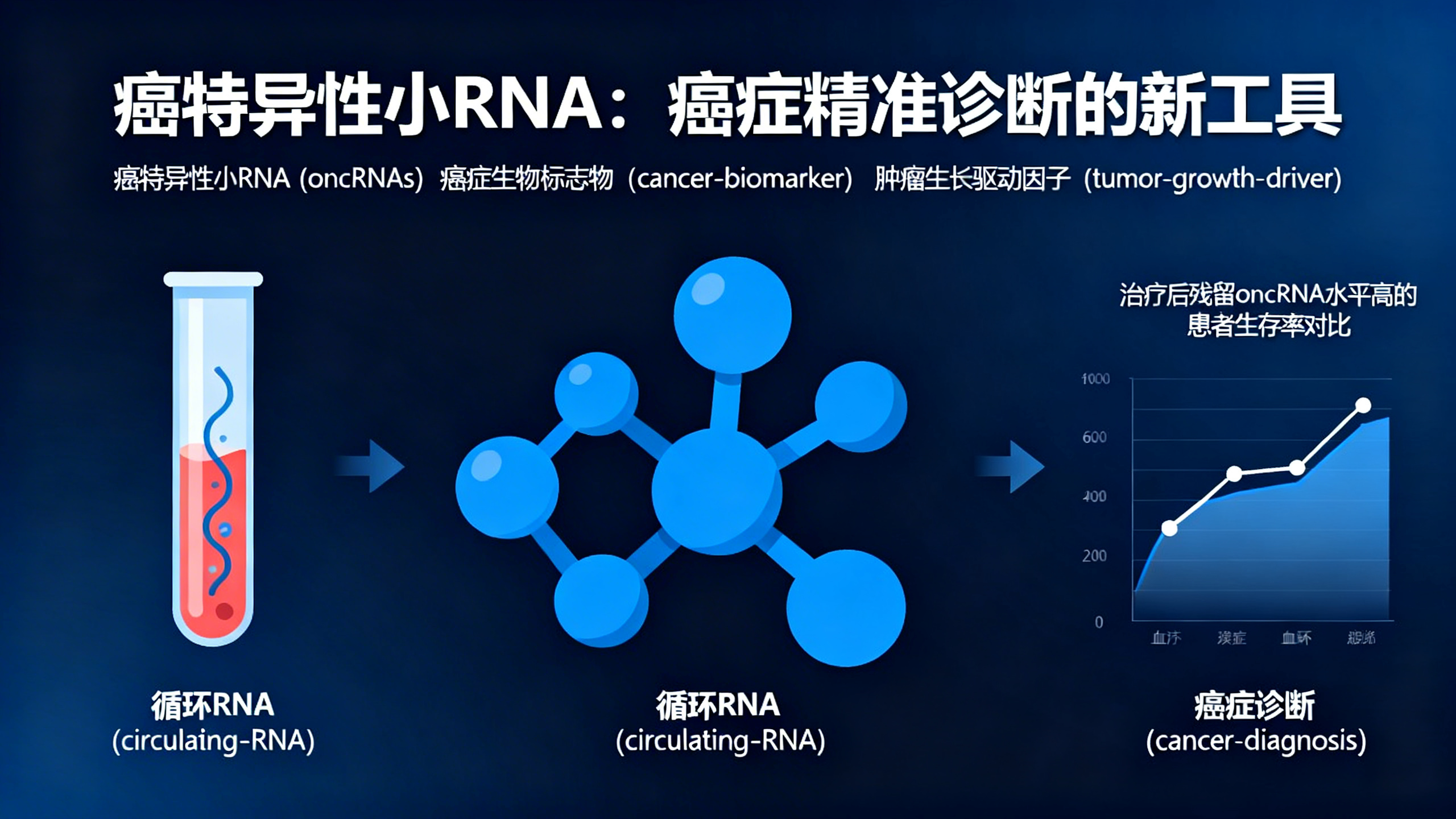
或许最具临床意义的发现是,癌细胞会主动将许多oncRNAs释放到血液中。追踪这些循环RNA有助于了解患者对治疗的反应。
我们分析了9种组织类型的25个癌细胞系的无细胞RNA,发现约30%的oncRNAs是主动分泌的。为证实其临床相关性,我们研究了192名参与I-SPY 2新辅助化疗试验的乳腺癌患者的血清样本。在治疗前后收集血液样本,并计算总oncRNA负荷的变化(即ΔoncRNA)。
这一单一检测结果信息量极大:化疗后残留oncRNA水平高的患者,总生存率几乎降低了4倍。即使考虑病理完全缓解、残留癌负荷等标准临床指标后,这种关联仍然显著。
这是我们最宏大的目标。尽管我们知道血液中可检测到oncRNAs,但不确定它们能否在真实患者样本中提供有意义的信息。仅从1毫升血清中检测到如此强烈的信号,这是出乎意料的。
**监测微小残留病灶的新方法**
这些发现解决了一个重要的临床难题。用无细胞DNA等标志物监测乳腺癌微小残留病灶十分困难,因为肿瘤(尤其是早期肿瘤)释放到血液中的DNA通常很少。而基于RNA的监测可能具有优势,因为癌细胞是主动分泌RNA,而非被动释放DNA。
**oncRNA研究的下一步**
目前仍存在重要的生物学和临床问题:功能性oncRNAs如何发挥作用?它们是否与蛋白质或其他RNA相互作用?实时追踪oncRNA变化能否指导治疗决策?它们能否帮助更早发现复发或改善患者分层?回答这些问题需要更广泛的研究和更大规模的前瞻性临床试验。
同时,转化应用已在推进中。血液中oncRNAs产生癌特异性信号这一发现正迈向临床应用。我们正与生物技术公司Exai Bio(哈尼是联合创始人)合作开发基于oncRNA的诊断方法。该公司已在构建人工智能模型并整合多样化数据集,以提高癌症检测和分类的准确性。
转化研究离不开众多贡献者。当对成千上万的样本进行计算分析时,很容易忘记每个样本都代表着一位志愿参与研究、捐献血液并希望自己的参与能帮助他人的个体。通过严谨科学来尊重这些贡献,是我们整个团队的动力。
我们认为,oncRNAs是一类新发现的癌症特异性分子,兼具疾病驱动因子和生物标志物的功能。通过公开这一资源,我们希望加速癌症生物学的研究进展并开辟新的研究方向。