单个细胞揭示宫颈“迷你器官”在沙眼衣原体感染时的免疫反应和细胞间交流
作者: aeks | 发布时间: 2025-10-06 20:59 | 更新时间: 2025-10-06 20:59
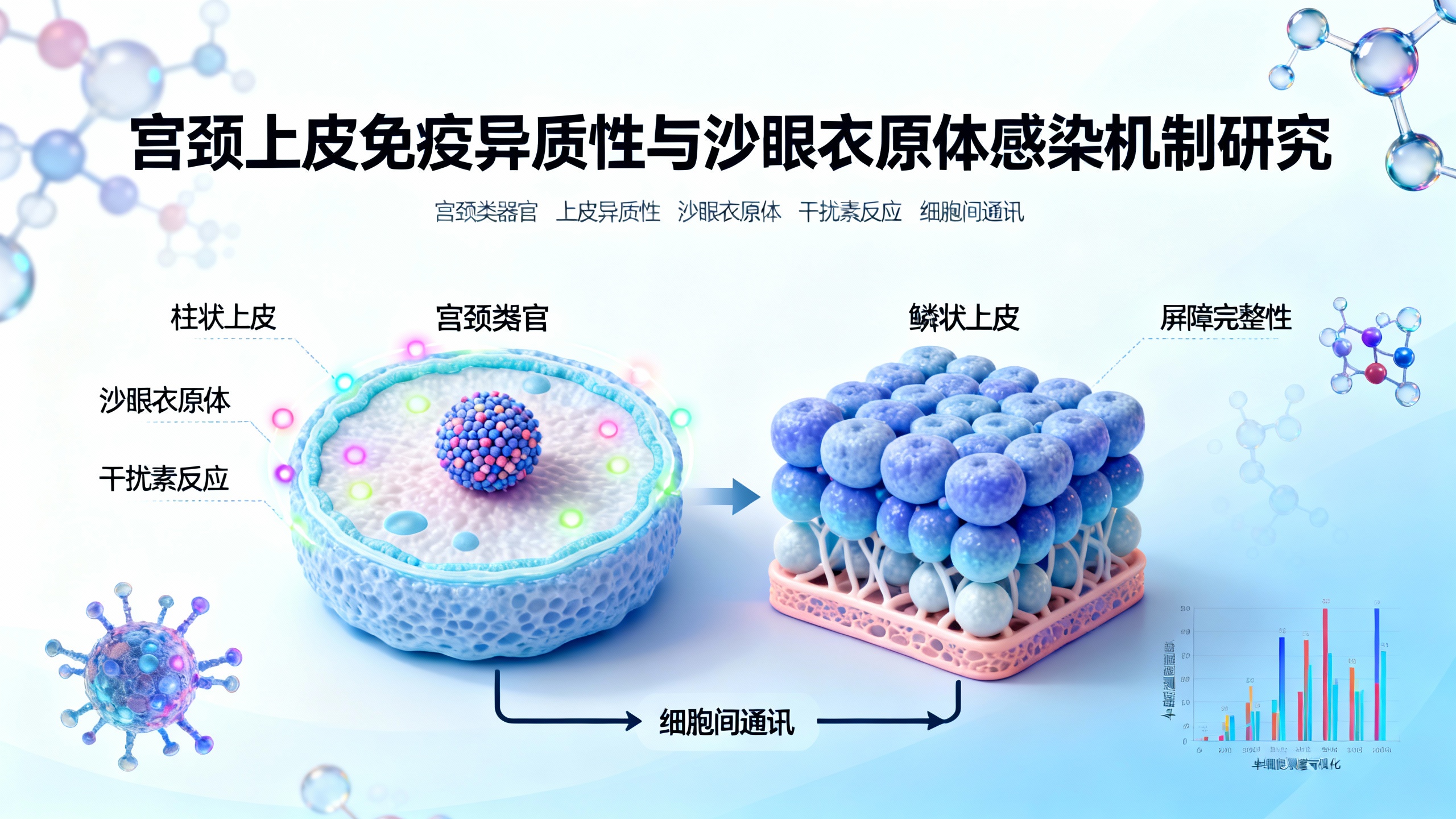
本研究通过结合患者来源的三维宫颈类器官、单细胞转录组学和天然组织分析,系统揭示了沙眼衣原体(Chlamydia trachomatis)感染期间宫颈上皮细胞的免疫异质性和细胞间通讯机制。研究首先验证了宫颈类器官在转录和细胞水平上高度模拟天然组织,确认其作为研究模型的可靠性。在此基础上,研究人员构建了高分辨率的宫颈上皮细胞多样性与免疫动态变化图谱。
研究发现,宫颈的两种主要上皮——外宫颈的复层鳞状上皮和内宫颈的柱状上皮——具有截然不同的免疫防御策略。感染发生时,外宫颈鳞状上皮主要通过增强屏障完整性和组织再生来应对,其免疫激活相对有限。相比之下,内宫颈柱状上皮,尤其是未被感染的“旁观者”细胞,在感染后表现出广泛的转录重编程,强烈激活干扰素通路、抗原呈递和抗菌肽等防御机制。这表明,即使未直接接触病原体,这些旁观者细胞也能被邻近的感染细胞发出的信号(如I型和III型干扰素)所激活,从而放大整体的黏膜免疫反应。
更深入的分析显示,感染极大地重塑了上皮细胞间的信号网络。在内宫颈,这些被重编程的旁观者细胞(特别是Co3B/C亚群)成为关键的信号枢纽,通过分泌CCL、CXCL、MHC-II、MIF、TNF和IL-1等分子,协调免疫反应和组织修复过程。而在外宫颈,细胞间的通讯更多地围绕NOTCH和TGF-β等维持上皮分层和屏障稳态的通路展开。
功能实验进一步证实,这种免疫激活具有实际效果。研究发现,内宫颈上皮细胞在感染后会大量分泌一种名为β-防御素(DEFB1)的抗菌肽,当用这种物质预处理沙眼衣原体后再进行感染时,其传染性显著降低,证明了上皮细胞自身具备直接抑制病原体的能力。此外,感染还以细胞类型特异性的方式调控上皮增殖:在外宫颈促进增殖,而在内宫颈反而抑制增殖,这可能与不同区域的组织重塑需求有关。
综上所述,该研究颠覆了传统认为上皮细胞只是被动物理屏障的观点,揭示了它们是主动的免疫调节者。宫颈上皮的不同区域形成了一个既分区又整合的内在免疫网络:内宫颈柱状上皮更侧重于“主动进攻”,通过强大的免疫信号和抗菌物质清除病原体;而外宫颈鳞状上皮则侧重于“固守阵地”,优先保证结构的完整。这一发现不仅深化了我们对女性生殖道黏膜免疫的理解,也为未来开发针对特定上皮亚群或关键信号通路(如干扰素和MIF-CD74/CD44通路)的靶向性黏膜疫苗或疗法提供了重要的理论依据和研究平台。