揭秘钴催化中的“分子钥匙”:带负电的有机钴如何精准完成立体化学反应
作者: aeks | 发布时间: 2025-10-12 07:16 | 更新时间: 2025-10-12 07:16
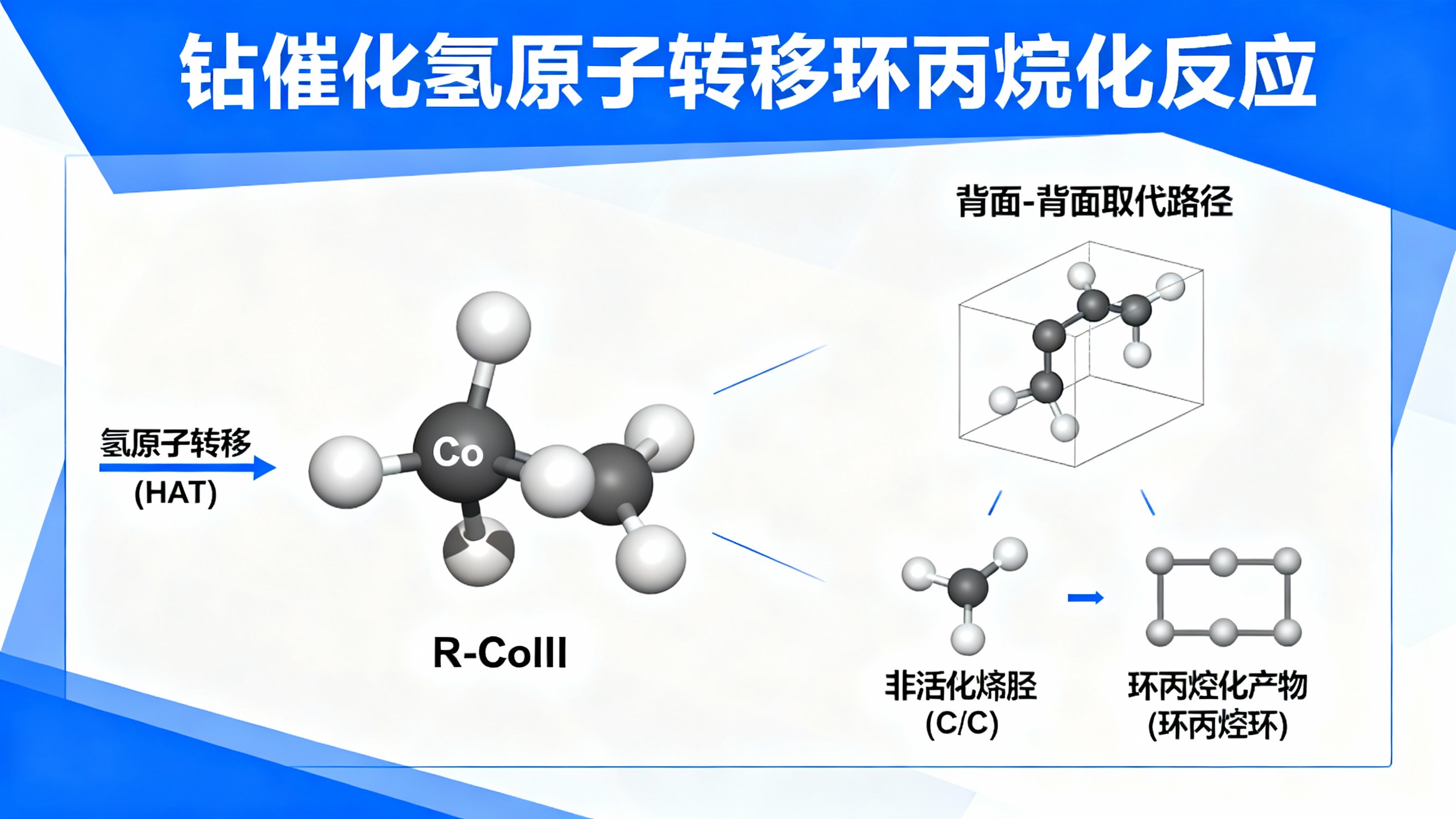
在有机合成中,金属氢化物介导的氢原子转移(MHAT)是一种重要的烯烃官能团化工具。其中,钴催化剂(特别是salen型结构)因其能形成稳定的烷基-CoIII中间体而被广泛应用。过去的研究主要集中在两种反应路径:一是该中间体发生均裂生成自由基(类型A),二是经氧化后作为碳正离子类似物参与反应(类型B)。然而,第三种可能——利用烷基-CoIII的双电子亲核性直接取代卤代烃等亲电试剂(类型C),由于C–Co键极性弱、难以活化,一直未被实现。
本文报道了一种全新的策略,通过引入碱性阴离子(如甲氧基)进行轴向配位,显著增强了烷基-CoIII的亲核能力,从而解锁了这种长期被忽视的反应模式。研究人员首先通过理论计算发现,当在钴中心引入强碱性配体时,烷基上的负电荷密度明显增加,说明其亲核性得到提升。随后,他们合成了明确结构的烷基-CoIII配合物,并在实验中验证:加入碳酸盐或甲氧基后,该配合物能快速发生分子内环化,生成环丙烷产物,且反应具有高度立体专一性——在亲核碳和离去基团所在的碳上均发生构型翻转,符合典型的SN2型取代特征。
基于这一发现,研究团队发展了一种钴催化的氧化还原中性环丙烷化反应。该反应使用简单易得的高烯丙基磺酸酯为原料,在钴催化剂、硅烷还原剂和碳酸钠碱的作用下,于乙醇溶剂中高效构建环丙烷结构。反应条件温和,对多种官能团兼容良好,尤其适用于不含稳定化取代基的非活化烯烃。产物以反式二取代环丙烷为主,非对映选择性最高可达17.2:1。
机理研究表明,反应经历以下步骤:钴氢物种对烯烃进行氢原子转移,生成烷基-CoIII中间体;随后,溶剂乙醇解离出的乙氧基从轴向配位到钴中心,使烷基具备足够亲核性,进而进攻分子内的磺酸酯基团,发生分子内环化形成三元环。此过程为背面对背面的双翻转机制,计算模拟也证实该路径能垒最低。此外,使用手性钴催化剂可获得一定的对映选择性,表明该体系未来有望实现不对称合成。
这项工作不仅首次实现了Co-MHAT催化中的亲核反应路径,还为合成化学提供了新的思路。以往难以参与极性反应的烷基钴物种,现在可通过简单的配体调控转化为高效亲核试剂,拓展了钴催化反应的应用边界。该方法无需贵金属、反应条件温和,具有良好的应用前景,预计将推动更多基于亲核型烷基-CoIII中间体的新反应开发。