运动员来源的微小颗粒通过阻止神经细胞“铁死亡”来保护脊髓损伤
作者: aeks | 发布时间: 2025-12-15 15:02 | 更新时间: 2025-12-15 15:02
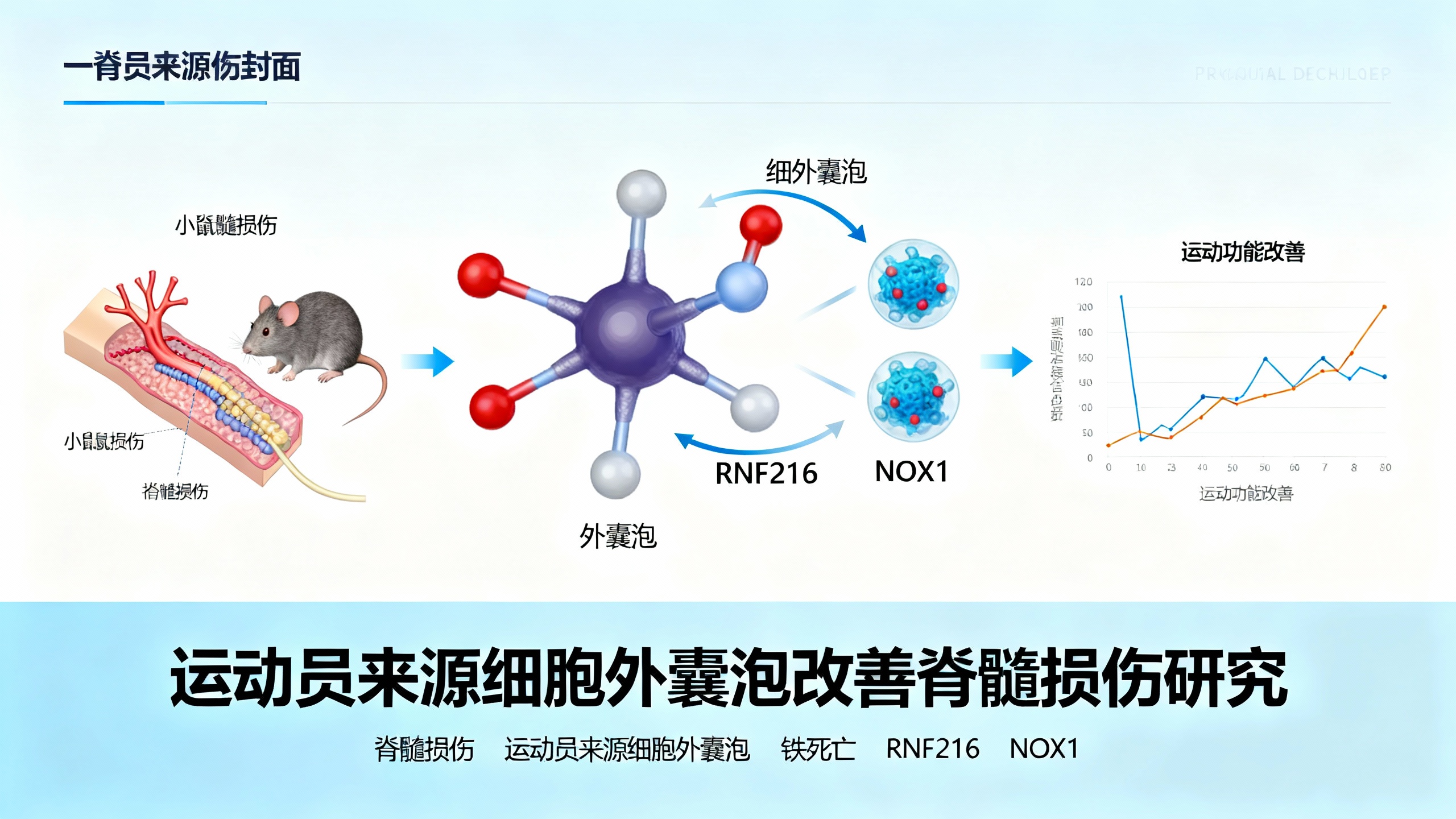
脊髓损伤(SCI)是一种致残率和致死率极高的疾病,患者常出现暂时或永久性的功能障碍,给社会和家庭带来沉重负担。目前的手术和药物治疗效果有限,因此亟需开发新的神经保护疗法。铁死亡是一种近年来发现的程序性细胞死亡方式,由铁依赖的活性氧积累和脂质过氧化驱动,在SCI等中枢神经系统损伤中起关键作用。细胞外囊泡(EVs)是细胞间通信的重要介质,因其能穿越血脑屏障递送生物活性物质,成为中枢神经系统损伤的潜在治疗剂。
本研究聚焦于运动员血浆来源的细胞外囊泡(AEVs)在SCI后的作用。研究团队首先在小鼠模型中发现,AEVs能显著抑制神经元铁死亡,改善运动功能恢复,效果优于普通人群来源的细胞外囊泡(GEVs)。进一步机制研究表明,AEVs通过递送RNF216蛋白发挥作用:RNF216作为E3泛素连接酶,可促进NOX1蛋白的泛素化降解。NOX1是产生活性氧的关键酶,其降解能减少氧化应激和铁死亡损伤。此外,富含RNF216的囊泡还能增强突触可塑性,支持神经元再生和神经网络重建。
为验证这一机制,研究人员通过慢病毒在神经干细胞中过表达RNF216,制备富含RNF216的神经干细胞来源囊泡(Ad-RNF216-NEVs)。动物实验显示,Ad-RNF216-NEVs能有效模拟AEVs的治疗效果,减少SCI后的铁死亡标志物(如ACSL4、4HNE)表达,恢复抗氧化蛋白GPX4水平,降低铁离子和脂质过氧化物积累,同时显著提高神经元存活率和轴突再生数量,改善小鼠的步态、平衡和感觉功能。反之,若在体内过表达NOX1,则会逆转AEVs的保护作用,说明RNF216-NOX1轴是AEVs发挥疗效的核心机制。
该研究首次揭示了RNF216-NOX1轴在SCI中的作用,并证实AEVs可作为一种新型治疗策略。相比传统干细胞来源的EVs,AEVs来源于血浆,具有产量高、易获取的优势,为SCI的临床治疗提供了新的思路和潜在手段。
标签: NOX1 RNF216 脊髓损伤 运动员来源细胞外囊泡 铁死亡