区分受控与失控的生长停滞,有助于精准治疗抗生素耐受问题
作者: aeks | 发布时间: 2026-01-18 18:04 | 更新时间: 2026-01-18 18:04
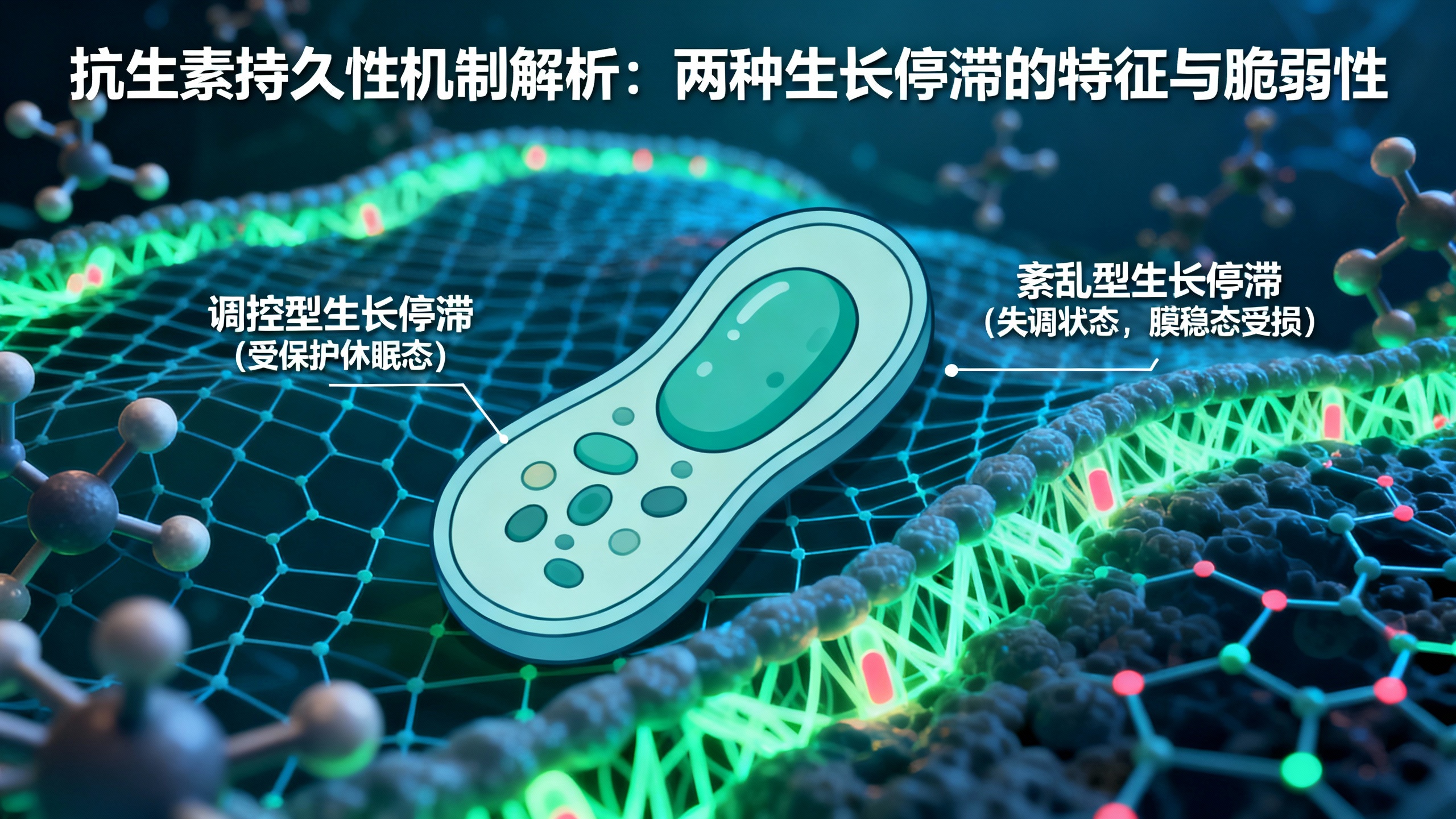
抗生素持久性通常与休眠细菌有关,是导致治疗失败的主要原因,但多年研究仍未就其机制达成共识。本研究表明,细菌在抗生素作用下的高存活性可能源于两种根本不同的生长停滞类型:一种是调控型生长停滞,会形成受保护的休眠细胞状态;另一种是失调的紊乱型生长停滞。研究团队通过建模和实验方法(包括转录组学、微量热法和微流控技术),揭示了每种生长停滞类型的特征和脆弱性。特别是,紊乱型细菌表现出膜稳态的普遍受损。这种认识解决了以往关于持留菌特征的矛盾结果,并有助于制定针对不同生长停滞细菌的治疗方案。调控型和紊乱型生长停滞之间的根本区别,应广泛适用于描述应激状态下的细胞。
研究首先通过两种方法诱导大肠杆菌进入生长停滞:自然饥饿(让培养物通过自然耗尽营养进入稳定期)和非自然饥饿(指数期培养物突然暴露于丝氨酸羟肟酸模拟急性营养剥夺)。两种生长停滞对氨苄西林的耐受性相似,但进一步实验揭示了根本差异。调控型生长停滞的细菌在营养补充后恢复时间短,蛋白质生产能力在饥饿期间保持稳定;而紊乱型生长停滞的细菌恢复时间差异大,且依赖饥饿持续时间,蛋白质生产能力不稳定。
模型和实验表明,调控型生长停滞是表型景观中的“吸引子状态”,细胞间变异性低,能快速统一响应外部信号;紊乱型则处于景观的“崎岖区域”,细胞间变异性高,响应迟缓。转录组分析显示,调控型细菌显著降低总mRNA水平、鞭毛和趋化相关基因及核糖体蛋白基因的表达,而紊乱型细菌的应激反应不充分,总mRNA水平与指数生长期细胞相似。微量热法测量发现,调控型细菌代谢率低,而紊乱型代谢率高且在无生长情况下维持数天。
此外,紊乱型生长停滞的细菌在膜稳态方面存在缺陷,对十二烷基硫酸钠(SDS)等膜靶向剂更敏感。不同干扰因素(如氯霉素、叠氮化钠)均可导致紊乱型生长停滞,其共同特征是恢复时间异质性、膜通透性增加和高敏感性。
这一发现解决了关于持留菌代谢活性水平的争议,解释了“耐受组”研究的困难,并为精准治疗提供框架:调控型细菌对营养+抗生素敏感,紊乱型则可通过膜靶向药物清除。这种生长停滞类型的区分对理解其他应激细胞系统(如癌症持留细胞)也具有重要意义。