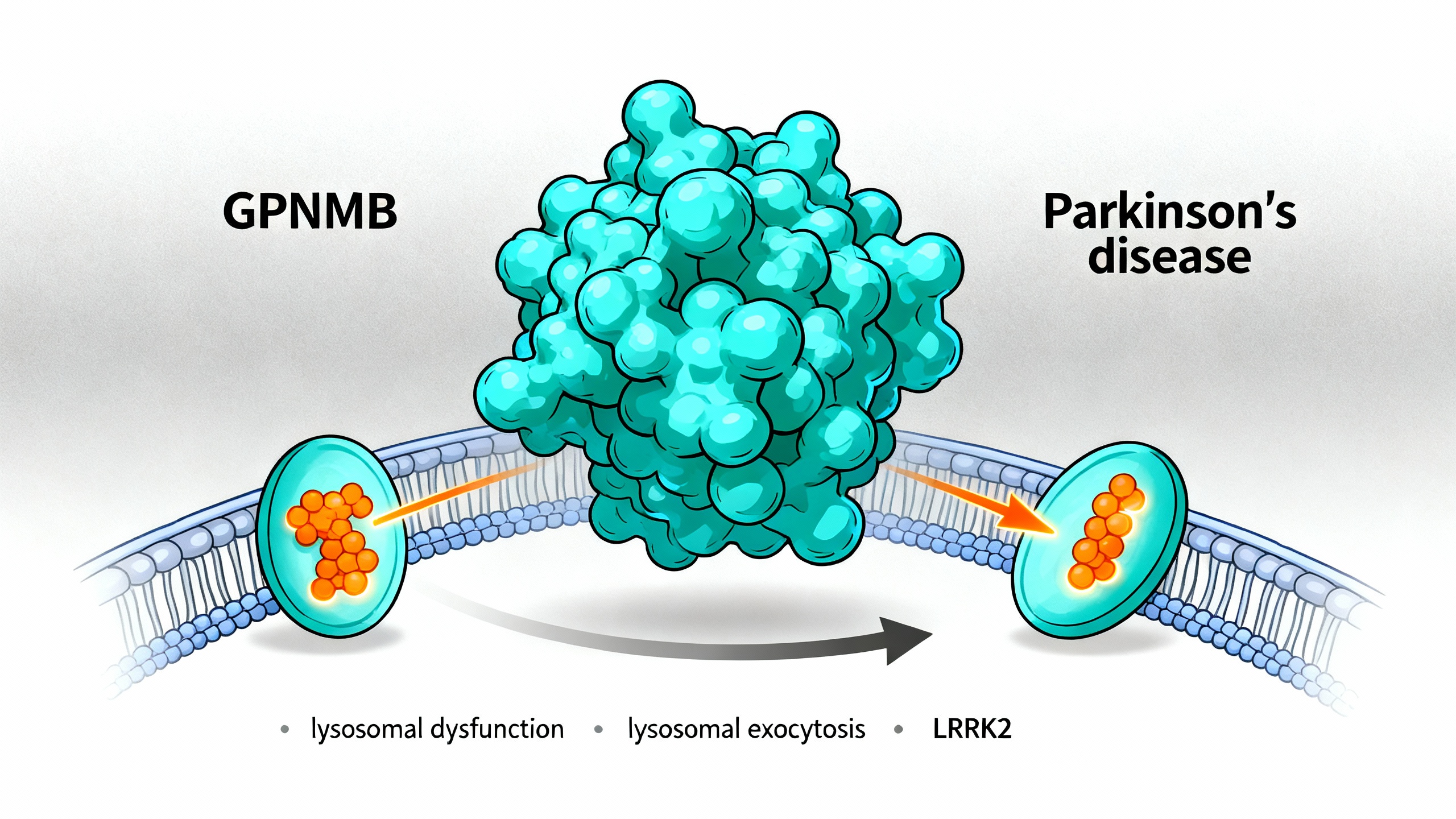
GPNMB是一种反映细胞“清道夫”功能异常的标志物,并通过LRRK2调控的方式从细胞中排出
作者: aeks | 发布时间: 2025-12-31 15:01 | 更新时间: 2025-12-31 15:01
学科分类: 基础医学
### 研究背景
帕金森病(PD)的遗传基础研究已发现超90个相关基因位点,糖蛋白Nmb(GPNMB)便是其中之一。携带GPNMB风险等位基因的人群患PD的终身风险增加10%,且其脑脊液(CSF)中GPNMB蛋白水平升高,提示GPNMB可能是PD的生物标志物。然而,GPNMB的功能及分泌机制尚不明确,阻碍了其作为标志物或治疗靶点的应用。GPNMB的转录受溶酶体应激响应因子TFEB调控,提示其与溶酶体功能相关;而PD的另一重要风险基因LRRK2也参与溶酶体 trafficking,但二者的关联尚未明确。本研究旨在探究GPNMB的分泌途径及其调控机制。
### 主要结果
1. **巨噬细胞在溶酶体应激下分泌GPNMB**:中脑单细胞测序显示,PD患者小胶质细胞(巨噬细胞的一种)中GPNMB表达显著升高。在巨噬细胞(如RAW264.7、骨髓来源巨噬细胞、iPSC分化小胶质细胞)中,溶酶体应激剂(如LLOMe、巴佛洛霉素A1)可诱导GPNMB分泌,而蛋白酶体抑制剂或LPS等非溶酶体应激剂则无此作用。
2. **溶酶体募集是GPNMB分泌的前提**:GPNMB的C端双亮氨酸基序(L562/L563)对其定位于溶酶体至关重要。该基序突变后,GPNMB无法进入溶酶体,转而错误定位至细胞膜,导致分泌减少,表明溶酶体募集是分泌的必要条件。
3. **GPNMB通过溶酶体胞吐作用分泌**:溶酶体胞吐是溶酶体与细胞膜融合释放内容物的过程。研究发现,溶酶体Ca²⁺通道TRPML1的激动剂可促进溶酶体胞吐及GPNMB分泌,拮抗剂则抑制该过程;且GPNMB分泌不依赖细胞外囊泡,证实其通过溶酶体胞吐释放。此外,ADAM10蛋白酶参与GPNMB的切割,但其并非唯一切割酶。
4. **LRRK2调控GPNMB分泌**:PD患者CSF分析显示,特发性PD(iPD)及GBA1突变携带者的GPNMB水平轻度升高,而LRRK2 G2019S突变携带者的GPNMB水平显著升高。细胞实验表明,LRRK2激酶活性增强(如G2019S突变)可促进GPNMB分泌,而抑制LRRK2激酶活性或敲除LRRK2则减少分泌,其机制可能与LRRK2调控溶酶体胞吐有关。
### 研究意义
本研究揭示溶酶体功能障碍是GPNMB分泌的触发因素,而LRRK2通过调控溶酶体胞吐参与这一过程。GPNMB可作为溶酶体应激的生物标志物,反映PD(尤其是遗传性PD)中的溶酶体功能异常,为PD的诊断及治疗靶点开发提供了新依据。