肺炎支原体是如何从人体细胞膜上“偷”脂质的?
作者: aeks | 发布时间: 2025-10-06 23:20 | 更新时间: 2025-10-06 23:20
肺炎支原体是一种能引起人类非典型肺炎的病原体。它自身无法合成某些关键脂质(如磷脂酰胆碱、鞘磷脂和固醇),因此必须从宿主细胞中“偷取”这些脂质来构建自己的细胞膜。这一过程不仅满足了它的营养需求,还有助于它逃避宿主的免疫系统攻击。
本研究的核心是揭示了支原体如何利用一种名为P116的关键蛋白来完成这项“偷窃”任务。研究人员发现,P116蛋白就像一个功能齐全的“脂质搬运工”,可以独立工作,不需要其他辅助蛋白或消耗能量(如ATP)。
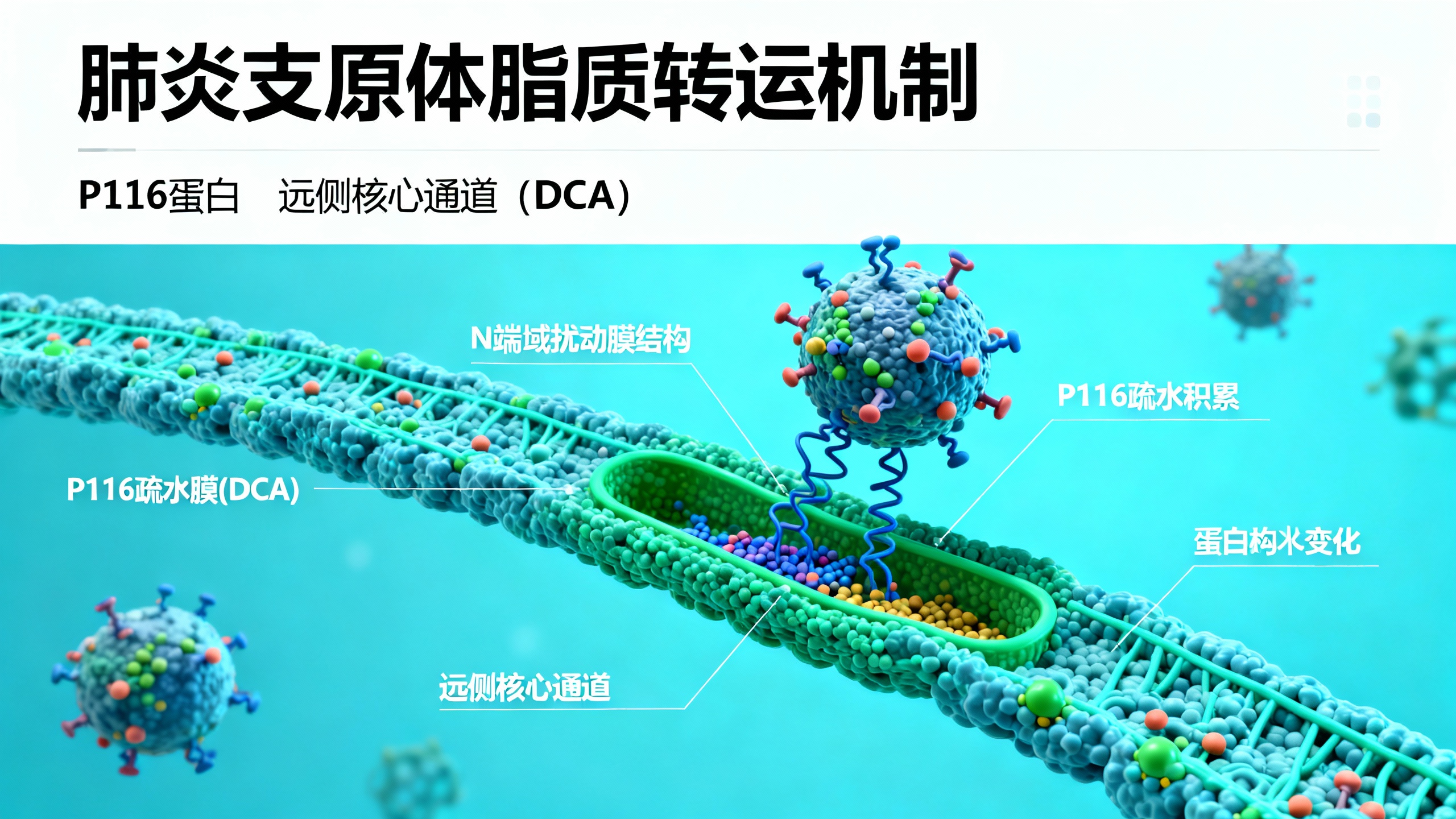
具体来说,P116的工作流程如下:首先,这个蛋白会靠近宿主的细胞膜。它的两个部分——N端结构域和一个富含苯丙氨酸的“F环”——会像钩子一样插入膜中,将自己牢牢地固定住。这种固定方式有两种:一种是让蛋白的“上侧”接触膜(D-docking),另一种是让“下侧”的特定氨基酸插入膜内(N-docking)。后者更为稳定,是进行脂质搬运的关键步骤。
一旦稳定附着,P116蛋白内部一个巨大的疏水性空腔就会打开一个叫作“远侧核心通道”(DCA)的入口。研究人员通过模拟实验发现,脂质分子要进入这个空腔,必须先将其疏水性的“尾巴”分开(这个过程称为“splaying”),然后一条一条地穿过DCA通道滑入空腔,而亲水的“头部”则留在外面。实验证明,只有DCA是脂质进入的唯一通道,其他可能的路径都被排除了。
最精巧的设计在于P116的“自动卸货”机制。当P116的空腔里装满了足够的脂质后,这些脂质货物本身会与内部的“F环”发生相互作用。这种相互作用会阻止“F环”再次插入宿主膜中,从而破坏了稳定的N-docking状态。结果就是,载满脂质的P116蛋白会自动从宿主膜上脱落下来,带着“赃物”离开。这就像一个智能的物流机器人,装满货后自动断开连接,准备去送货。
整个过程中,P116蛋白的灵活性至关重要,尤其是在连接N端和核心结构域的“铰链区”。这个区域的高度柔性使得N端和F环能够自由活动,从而完成对膜的识别、锚定和脂质的提取。
这项研究的意义在于,它揭示了一种极其简洁高效的生物运输系统。与高等生物中复杂的多蛋白协作运输不同,肺炎支原体仅用一个蛋白就完成了从识别、提取、装载到脱离的全过程。这不仅帮助我们理解了这种简单生命形式的生存策略,也为未来设计人工合成的分子运输机器提供了重要的灵感和蓝图。