人类前体滤泡调节性T细胞已准备好分化为成熟Tfr,并在严重感染期间被破坏
作者: aeks | 发布时间: 2025-10-04 23:17 | 更新时间: 2025-10-04 23:17
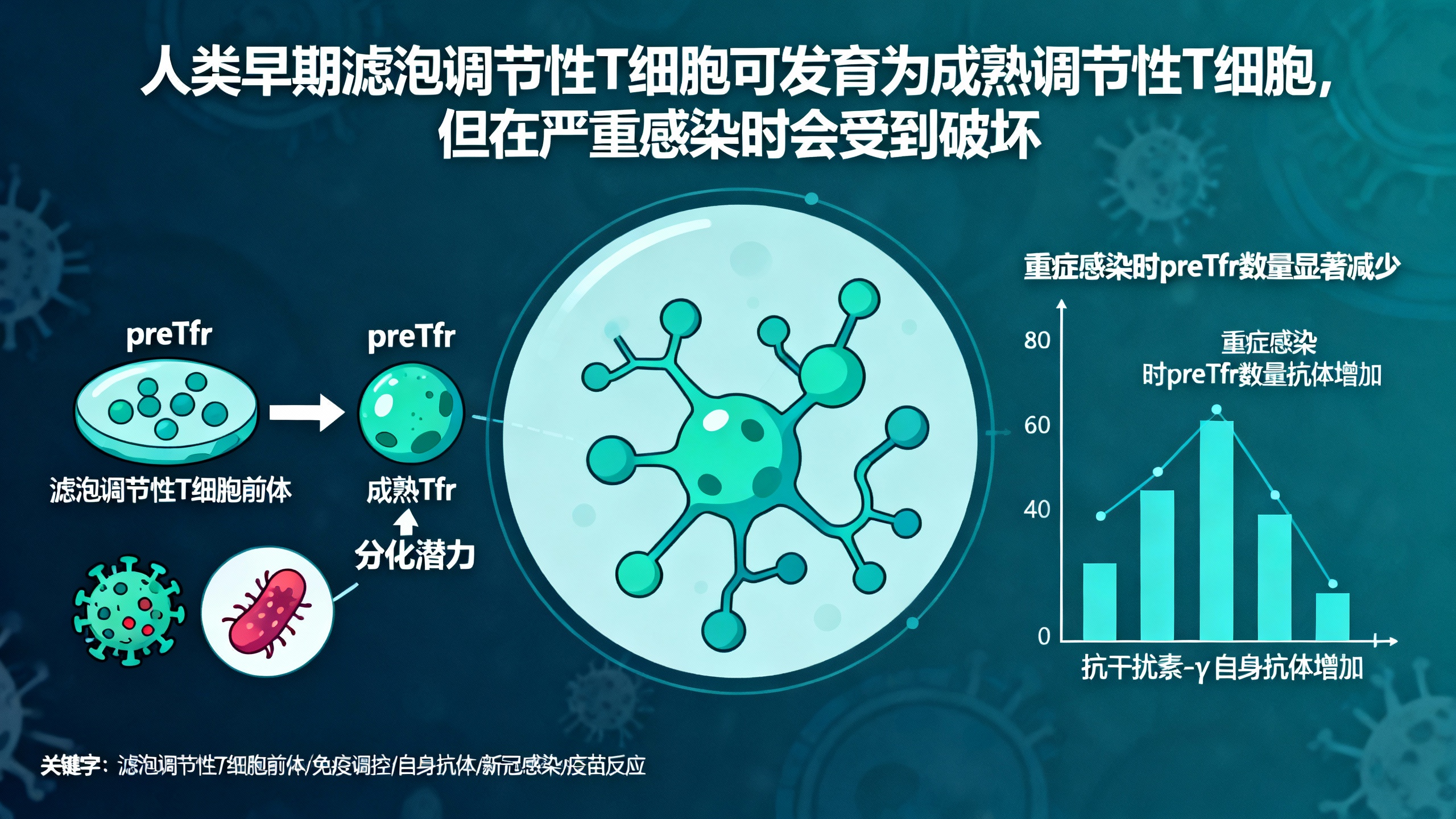
本研究揭示了一类存在于人体血液中的特殊调节性T细胞——滤泡调节性T细胞前体(preTfr)。这类细胞表达CD45RA和CXCR5,形态上类似于初始调节性T细胞(nTreg),但具备向成熟滤泡调节性T细胞(Tfr)分化的潜能。Tfr细胞在免疫系统中扮演着“刹车”角色,主要功能是抑制过度活跃的免疫反应,防止产生有害的自身抗体,从而维持免疫系统的平衡。
研究人员通过对新冠重症患者、败血症患者以及健康人群的大规模纵向样本分析发现,在健康人血液中,preTfr约占循环Tfr细胞的30%至50%。这些细胞不仅可在体外扩增,还保留了抑制其他免疫细胞活化的能力。基因测序结果显示,preTfr与nTreg在静息状态下非常相似,但在受到刺激后,会显著上调IL-1RA等与Tfr功能相关的抑制性分子,说明它们正处于向成熟Tfr分化的“预备状态”。
更重要的是,研究发现,在新冠和败血症等严重感染期间,患者血液中的preTfr数量明显下降,而成熟Tfr细胞也同步减少。与此相反,经典的nTreg细胞数量则保持稳定。这一差异表明,严重疾病可能特异性地破坏了Tfr细胞发育的最早阶段。preTfr的减少还与体内出现更多抗干扰素-γ的自身抗体密切相关,同时伴随着一类异常活化的B细胞增多。由于干扰素-γ是抵抗病毒感染的关键因子,针对它的自身抗体会削弱免疫防御能力,可能导致病情恶化。统计分析还显示,preTfr水平较低的新冠患者死亡风险更高,提示这类细胞可能具有保护作用。
此外,研究观察到,在接种新冠mRNA疫苗后,preTfr和成熟Tfr的数量都会有所上升,尤其是在多次接种后更为明显,而nTreg则无明显变化。这说明疫苗能有效激活并扩增这条免疫调控通路。preTfr的数量还与参与疫苗应答的其他免疫细胞(如滤泡辅助T细胞和特定B细胞)呈正相关,进一步支持其在疫苗免疫反应中的积极作用。
有趣的是,研究还发现preTfr具有一种非传统的功能:在特定条件下,它们分泌的物质能促进皮肤细胞的伤口愈合,这种能力优于普通的nTreg。这表明preTfr的功能不仅限于免疫抑制,还可能参与组织修复。在扁桃体组织中,科学家也发现了preTfr的存在,并观察到部分细胞正在向组织驻留型Tfr过渡,证实了其作为前体细胞的生物学地位。
综上所述,preTfr是一类独特的免疫细胞,是成熟Tfr的直接前体。它们在维持免疫耐受、防止自身免疫病和调控疫苗反应中发挥重要作用。在重症感染中,preTfr的缺失可能是导致免疫紊乱和自身抗体产生的关键原因。这一发现为未来开发治疗自身免疫病或优化疫苗策略提供了新思路,例如可通过体外扩增preTfr进行细胞治疗,以增强机体的免疫调控能力。
标签: 免疫调控 新冠感染 滤泡调节性T细胞前体 疫苗反应 自身抗体