黏膜疫苗可清除艰难梭菌定植
作者: aeks | 发布时间: 2026-02-20 06:06 | 更新时间: 2026-02-20 06:06
艰难梭菌是一种产芽孢的厌氧细菌,是医院感染的主要原因,也是抗生素相关性腹泻的首要病因。仅在美国,每年约有50万例艰难梭菌感染(CDI)病例,导致2.9万人死亡,医疗成本高达48亿美元。因此,研发CDI疫苗的努力一直在进行。
以往的CDI疫苗策略主要针对主要毒力因子——毒素TcdA和TcdB。辉瑞公司的双价TcdA/TcdB疫苗在III期临床试验中虽能预防严重感染,但未达到预防感染的主要终点;赛诺菲的疫苗因无效性标准而终止。最近,一种多价mRNA-脂质纳米颗粒候选疫苗在临床前研究中显示出保护小鼠免受严重感染和死亡的潜力,但这些策略都未能有效清除结肠中的细菌,而这对于阻止艰难梭菌通过粪-口途径传播至关重要。30%的CDI复发率以及健康成人中社区获得性CDI病例的增加,凸显了优先考虑清除艰难梭菌的免疫策略的必要性。
本研究建立了一种既能增强艰难梭菌清除能力,又能保护机体免受CDI症状影响的疫苗接种方法。该策略包括:选择新型营养体和芽孢抗原以促进艰难梭菌的清除;对艰难梭菌毒素抗原进行灭活点突变,保留其天然结构以实现广泛的表位识别;使用大肠杆菌热不稳定毒素双突变体(dmLT)作为黏膜佐剂;比较直肠给药(黏膜免疫)和腹腔注射(非肠道免疫)途径;评估体液和细胞免疫指标以确定症状减轻和病菌清除的相关因素。研究最终开发出一种保护性黏膜疫苗制剂,能够引发灭菌免疫,从宿主体内清除艰难梭菌。
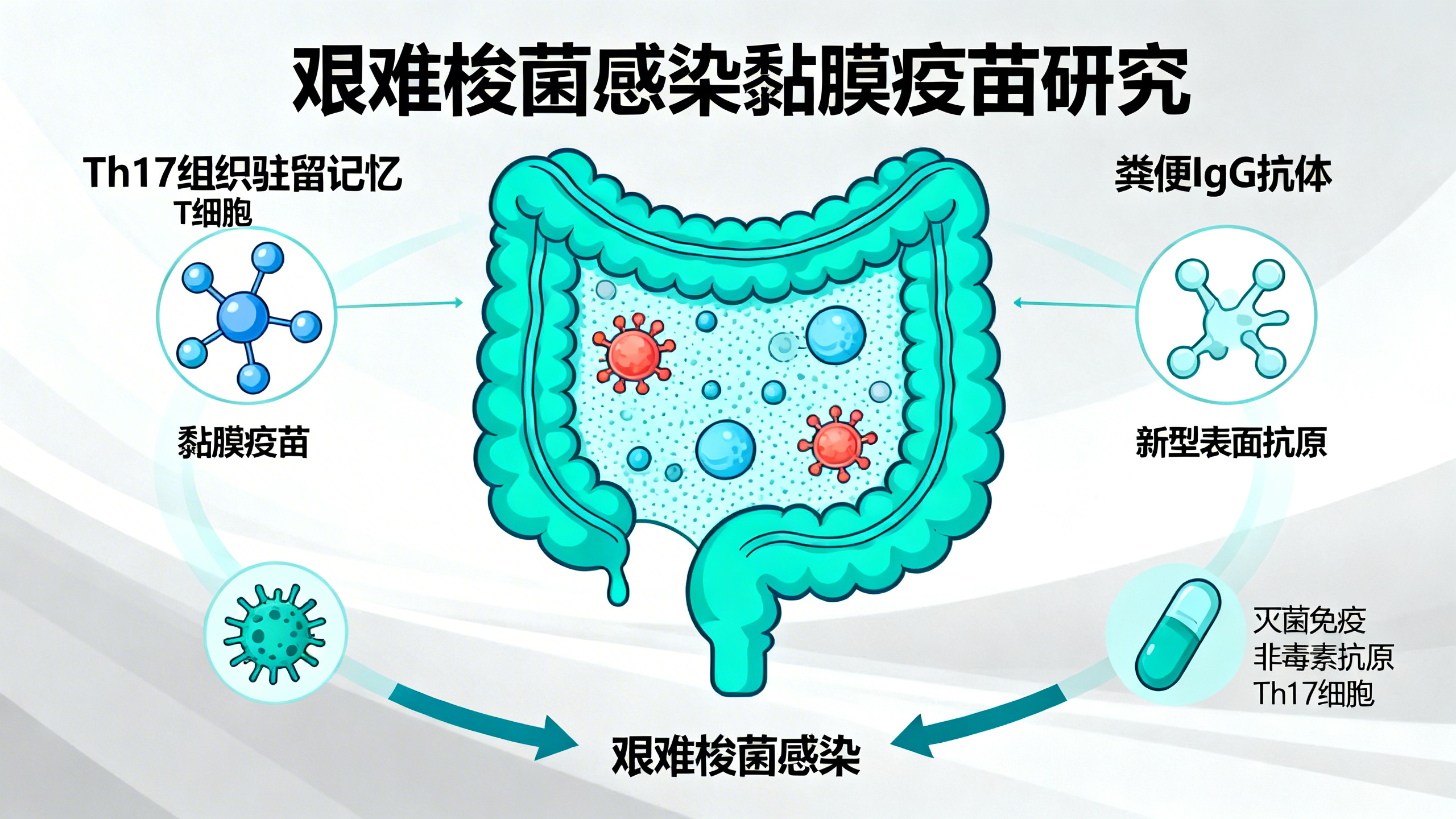
研究首先筛选了16种与细胞表面功能相关的艰难梭菌非毒素抗原(NTA),预测其低致敏性、高抗原性等特性,并重组表达纯化了其中13种,优先选择了FlgGEK(鞭毛基体杆组件的三元复合物)、C40肽酶2(细胞壁修饰酶)、多糖脱乙酰酶(肽聚糖脱乙酰酶)和CspC(芽孢外壳结合的萌发受体)。通过直肠灌注(r.i.)或腹腔注射(i.p.)给小鼠接种NTA混合物和dmLT佐剂,发现两种途径都能保护小鼠免受野生型艰难梭菌致死性攻击,但只有直肠接种能显著降低毒素缺陷株的定植负荷,而腹腔接种无此效果。单独直肠接种CspC、C40肽酶2和FlgGEK也能减少定植负荷。直肠接种后,小鼠粪便中针对营养体抗原的IgG水平升高,而腹腔接种则诱导更高的血清IgG和粪便IgA。
随后,研究将NTA与灭活毒素结合,采用两剂初免-加强方案。直肠接种该联合疫苗能在感染后第9天清除细菌,第8天清除芽孢,保护小鼠免受体重减轻、上皮损伤和死亡,并能预防万古霉素诱导的复发感染;而腹腔接种则无法清除病菌。进一步研究发现,粪便中针对C40肽酶2和FlgGEK的IgG能减少营养体细菌负荷并阻碍其运动;直肠接种还诱导结肠中CD8+和CD4+组织驻留记忆T细胞(TRM),其中CspC能激活Th17相关细胞因子反应。此外,该黏膜疫苗具有长效性,在最后一次免疫后60天和200天仍能保护小鼠清除病菌和免受感染。
总之,本研究开发的直肠黏膜疫苗通过诱导粪便IgG和Th17型TRM细胞,实现了对艰难梭菌的灭菌免疫,为CDI疫苗的研发提供了新方向。