按需启动的癌症免疫治疗:用人工设计细胞的微型胶囊实现
作者: aeks | 发布时间: 2026-01-17 00:03 | 更新时间: 2026-01-17 00:03
肺癌转移是癌症相关死亡的主要原因,占实体瘤死亡人数的30%以上。目前的治疗方法存在诸多局限:局部手术和放疗难以靶向2毫米以下的微转移灶,全身化疗对健康组织毒性大,且肺泡-毛细血管屏障阻碍药物到达肺部(不足5%的化疗药物能达到治疗浓度)。免疫疗法虽能调动自身免疫对抗转移瘤,但免疫治疗剂的失控释放可能引发过度免疫激活,如CAR-T细胞疗法常导致细胞因子释放综合征(CRS),严重者死亡率超10%,因此亟需动态控制系统。
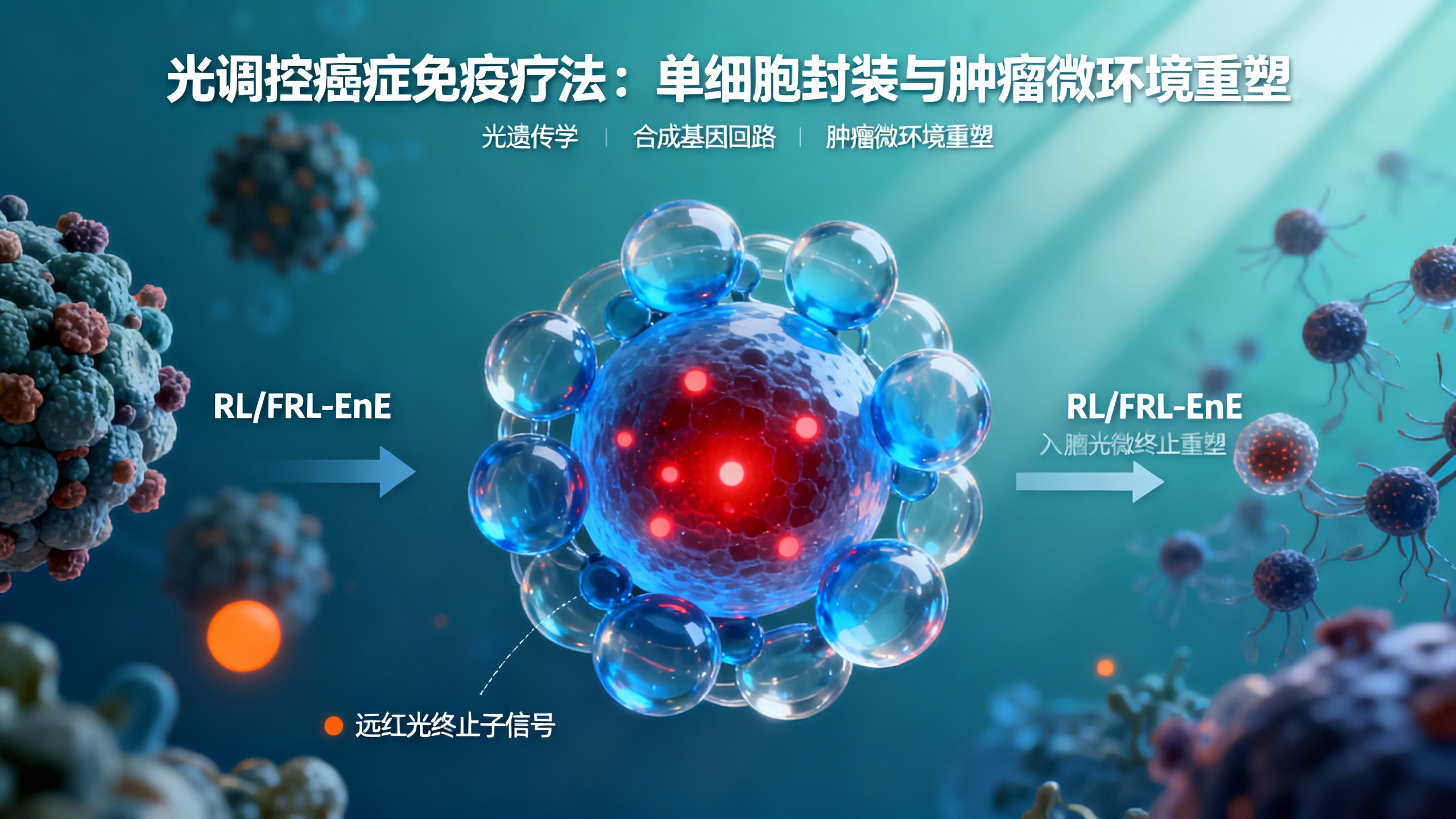
本研究开发了一种红/远红光调控的单个封装(RL/FRL-EnE)细胞系统,将光遗传学与生物材料封装结合,实现免疫调节因子的动态可逆控制。该系统核心是基于光敏蛋白PhyA的光开关模块(ΔPhyA),通过与藻蓝素(PCB)结合获得光感应特性。在660纳米红光(RL)照射下,ΔPhyA与远红光 elongated hypocotyl 1(FHY1)形成异二聚体,启动干扰素-γ(IFN-γ)、CD47抗体和白细胞介素-6(IL-6)的同步表达;而740纳米远红光(FRL)照射会使PhyA发色团光转化,导致复合物解离,迅速终止细胞因子产生。
为实现单细胞封装,研究人员利用HRP-pHLIP融合蛋白在细胞表面原位聚合透明质酸(HA)水凝胶。HA水凝胶可让氧气、离子和分泌蛋白自由扩散,同时保护细胞免受免疫清除,并通过HA与肿瘤细胞高表达的CD44受体结合,增强肿瘤靶向性。体外实验表明,封装细胞在红光照射下能稳定分泌免疫因子,且分泌量与光照强度和时间呈剂量依赖关系,远红光可有效关闭分泌,该系统在12天内保持可逆调控能力。
体内实验中,Cy5标记的封装细胞在血液中留存超24小时(未封装细胞12小时内被清除),且通过HA-CD44相互作用特异性富集在肺肿瘤中。局部红光照射仅在肺部诱导治疗基因表达,避免肝脏等部位的脱靶激活。在4T1肺癌转移模型中,RL/FRL-EnE细胞治疗组肿瘤负荷最低,显著优于对照组。该治疗能减少肺组织中免疫抑制性细胞(如SIRPα+巨噬细胞、MDSCs)1.3-1.7倍,同时增加树突状细胞(1.4倍)和CD8+ T细胞(2.8倍)浸润,且未引发CRS相关毒性(如白细胞增多、血小板减少)。
综上,RL/FRL-EnE细胞系统通过光控“活体药物工厂”实现按需免疫重编程,为精准、安全的癌症免疫治疗提供了新思路。未来可优化光穿透深度(如结合超声基因系统)和开发个性化细胞回路,以适应不同患者的免疫微环境。