可光照激活的微藻抗癌新利器
作者: aeks | 发布时间: 2025-10-10 18:01 | 更新时间: 2025-10-10 18:01
学科分类: 化学工程与技术 材料科学与工程 生物医学工程 生物学
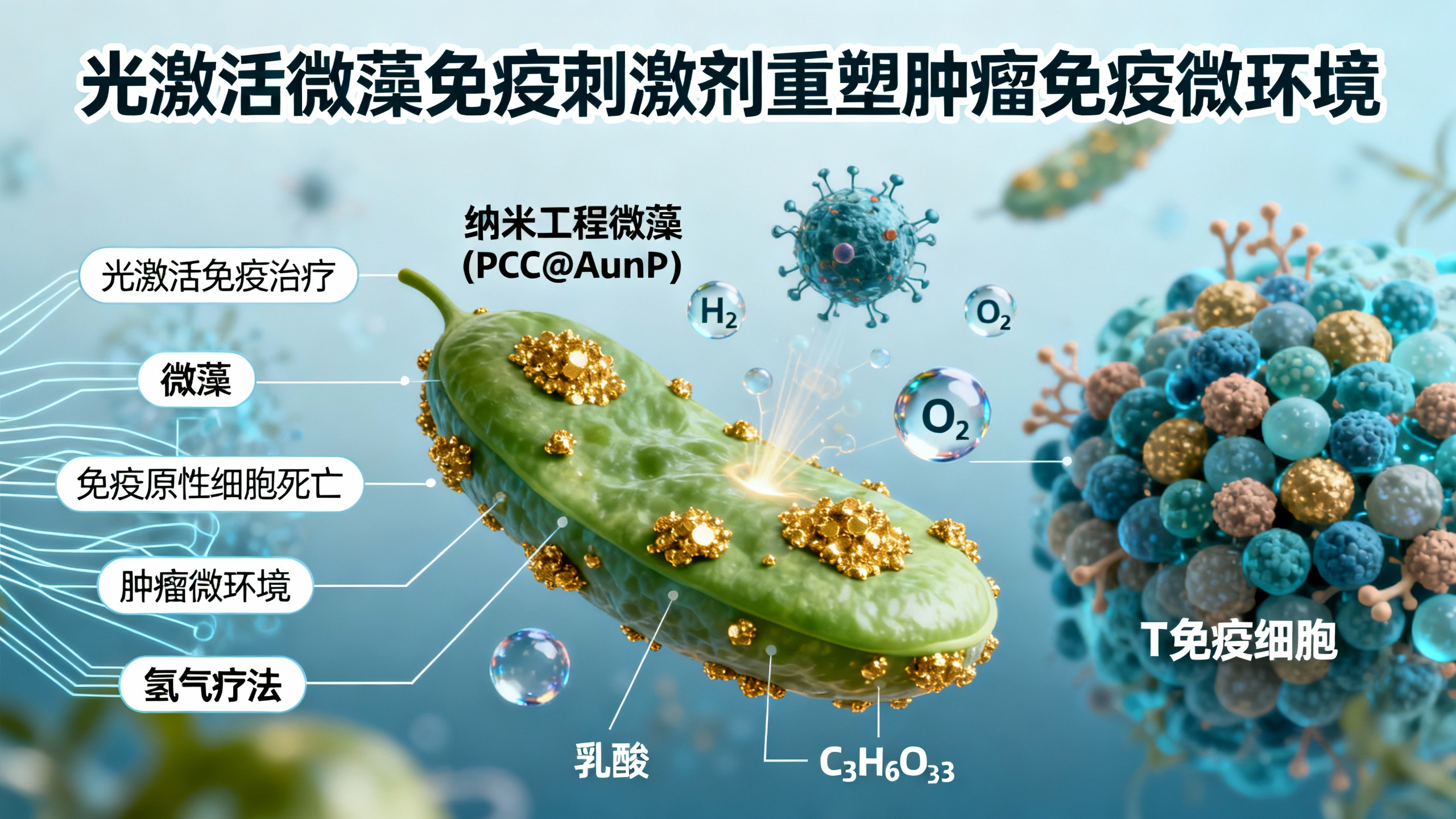
癌症免疫治疗面临两大难题:一是肿瘤自身免疫原性低,难以被免疫系统识别;二是肿瘤微环境(TME)具有强烈的免疫抑制特性,阻碍免疫细胞发挥作用。为解决这些问题,研究人员开发了一种名为PCC@AuNP的新型光激活免疫刺激剂。它以一种名为集胞藻PCC 7942的微藻为基础,通过在其表面连接金纳米颗粒(AuNPs)进行改造,形成一种能响应红光照射的智能生物系统。
当这种微藻被注射到肿瘤部位并接受635纳米红光照射时,会启动多重抗肿瘤机制。首先,光照激发微藻表面的金纳米颗粒,引发光催化反应,将肿瘤内大量积累的乳酸分解,同时产生氢气(H₂)。这种氢气能特异性地在癌细胞内引发严重的内质网应激和线粒体功能障碍,导致癌细胞发生“免疫原性细胞死亡”(ICD)。这意味着死亡的癌细胞会释放出一系列信号分子,如钙网蛋白(CRT)、高迁移率族蛋白B1(HMGB1)和三磷酸腺苷(ATP),这些信号就像“吃我”和“找我”的求救信号,能够吸引并激活树突状细胞(DC),进而启动强大的抗癌免疫反应。
与此同时,微藻本身具备光合作用能力,在光照下可持续产生氧气(O₂)。这不仅能有效缓解肿瘤内部的缺氧状态,还能与光催化消耗乳酸的过程协同作用,共同改善免疫抑制的微环境。充足的氧气和降低的乳酸水平,有助于减少调节性T细胞(Treg)和髓源性抑制细胞(MDSC)等“坏”免疫细胞的浸润,同时促进肿瘤相关巨噬细胞从促肿瘤的M2型向抗肿瘤的M1型转化。更重要的是,这一系列改变显著增强了细胞毒性T淋巴细胞(CTL)的活性和浸润能力,使它们能更有效地攻击和清除癌细胞。
在黑色素瘤小鼠模型中的实验结果令人振奋。经过PCC@AuNP结合激光照射的治疗后,不仅原发肿瘤的生长被显著抑制(抑制率达91.8%),连未直接接受治疗的远端肿瘤也受到了强烈抑制(抑制率达93.1%),这表明治疗成功激发了全身性的抗肿瘤免疫反应,即所谓的“远端效应”。研究人员还观察到,治疗组小鼠的生存期明显延长。尤为关键的是,全面的安全性评估显示,该疗法对小鼠的主要器官(心、肝、脾、肺、肾)没有造成任何明显的毒副作用,血液指标也保持正常,证明其具有很高的生物安全性。
总结来说,这项研究巧妙地结合了合成生物学和纳米技术,利用天然微藻作为活体平台,实现了在肿瘤局部按需、可控地产生多种有益气体(H₂和O₂)并消耗有害代谢物(乳酸)。这种“一石多鸟”的策略,同时解决了增强肿瘤免疫原性和逆转免疫抑制微环境这两个核心问题,为癌症免疫治疗开辟了一条全新的、精准且安全的道路。未来,通过结合上转换纳米材料或光纤技术,有望将这种光激活疗法应用于更深的肿瘤组织,具有广阔的临床应用前景。