基因组研究发现一个关键“剪接因子”促进肝癌发展
作者: aeks | 发布时间: 2025-10-11 22:27 | 更新时间: 2025-10-11 22:27
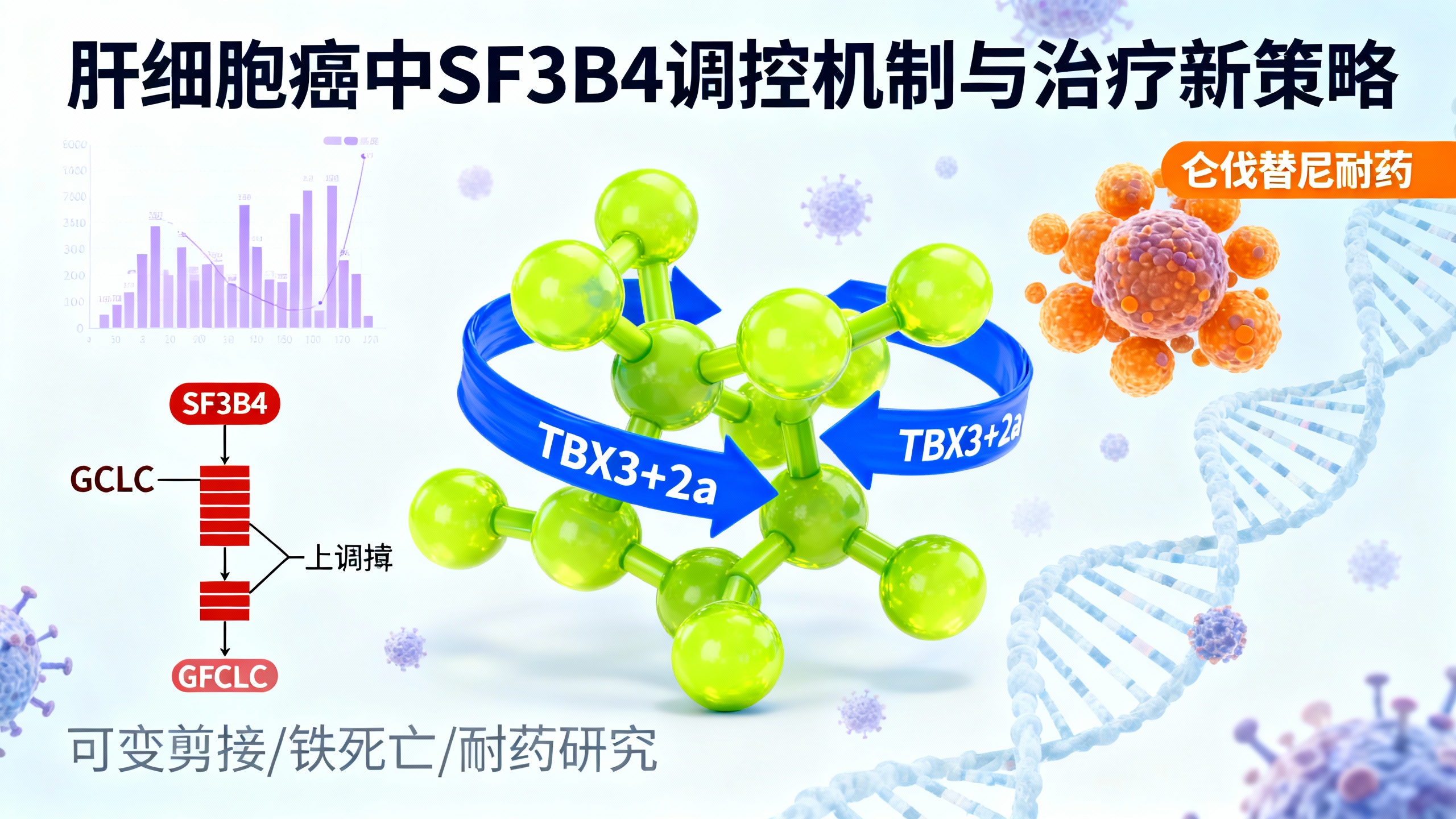
这项研究利用全基因组CRISPR敲除技术,在源自患者的肝细胞癌(HCC)类器官模型中系统探索了肿瘤生存必需基因及对一线药物仑伐替尼耐药的机制。研究发现,剪接体因子在HCC中具有重要功能,其中剪接因子SF3B4是维持癌细胞存活的关键分子。SF3B4在多数HCC肿瘤中表达升高,其高表达与患者预后较差相关。实验表明,敲除SF3B4会导致癌组织类器官自发死亡,而过表达SF3B4则能促使正常肝类器官出现癌前病变特征,并显著增强其在小鼠体内的成瘤能力。
进一步研究发现,SF3B4通过结合特定RNA区域,调控大量基因的可变剪接过程,尤其影响“外显子盒”类型的剪接事件。研究人员鉴定出一种名为TBX3+2a的转录因子剪接变体是SF3B4的重要下游效应分子。TBX3+2a的生成依赖于SF3B4的表达,且该变体在促进癌细胞生长中发挥关键作用。这揭示了一条“SF3B4-TBX3+2a”促癌信号通路。
此外,由于所用类器官本身对仑伐替尼耐药,研究团队借此发现了耐药新机制:谷氨酸-半胱氨酸连接酶催化亚基(GCLC)介导的抗铁死亡通路被异常激活。铁死亡是一种由脂质过氧化引发的程序性细胞死亡形式,而GCLC是合成抗氧化物质谷胱甘肽的关键酶。研究显示,在耐药肿瘤中GCLC等铁死亡抑制因子表达上调;降低GCLC表达可使癌细胞重新对仑伐替尼敏感,并伴随铁死亡标志物增加和脂质过氧化加剧。相反,提高GCLC表达则会增强耐药性。
更有意义的是,研究发现SF3B4的功能与铁死亡调控存在关联:抑制SF3B4不仅能抑制肿瘤生长,还能激活铁死亡,从而增强仑伐替尼疗效。动物实验进一步证实,使用剪接体调节剂H3B-8800或铁死亡诱导剂(如IKE、BSO)均能有效抑制肿瘤生长,并显著提升仑伐替尼的治疗效果。
综上所述,该研究不仅揭示了SF3B4在肝癌发生发展中的核心作用及其通过调控TBX3+2a剪接促进癌变的分子机制,还阐明了GCLC介导的抗铁死亡是导致仑伐替尼耐药的重要原因。这两条通路为肝癌治疗提供了新的干预靶点。研究也展示了基于患者类器官的CRISPR筛选技术在发现癌症脆弱环节和推动精准治疗方面的巨大潜力。