新型纳米疗法:激活氧化反应,增强抗癌免疫、阻断癌细胞与神经“勾结”,对抗骨转移和癌痛
作者: aeks | 发布时间: 2026-01-26 03:01 | 更新时间: 2026-01-26 03:01
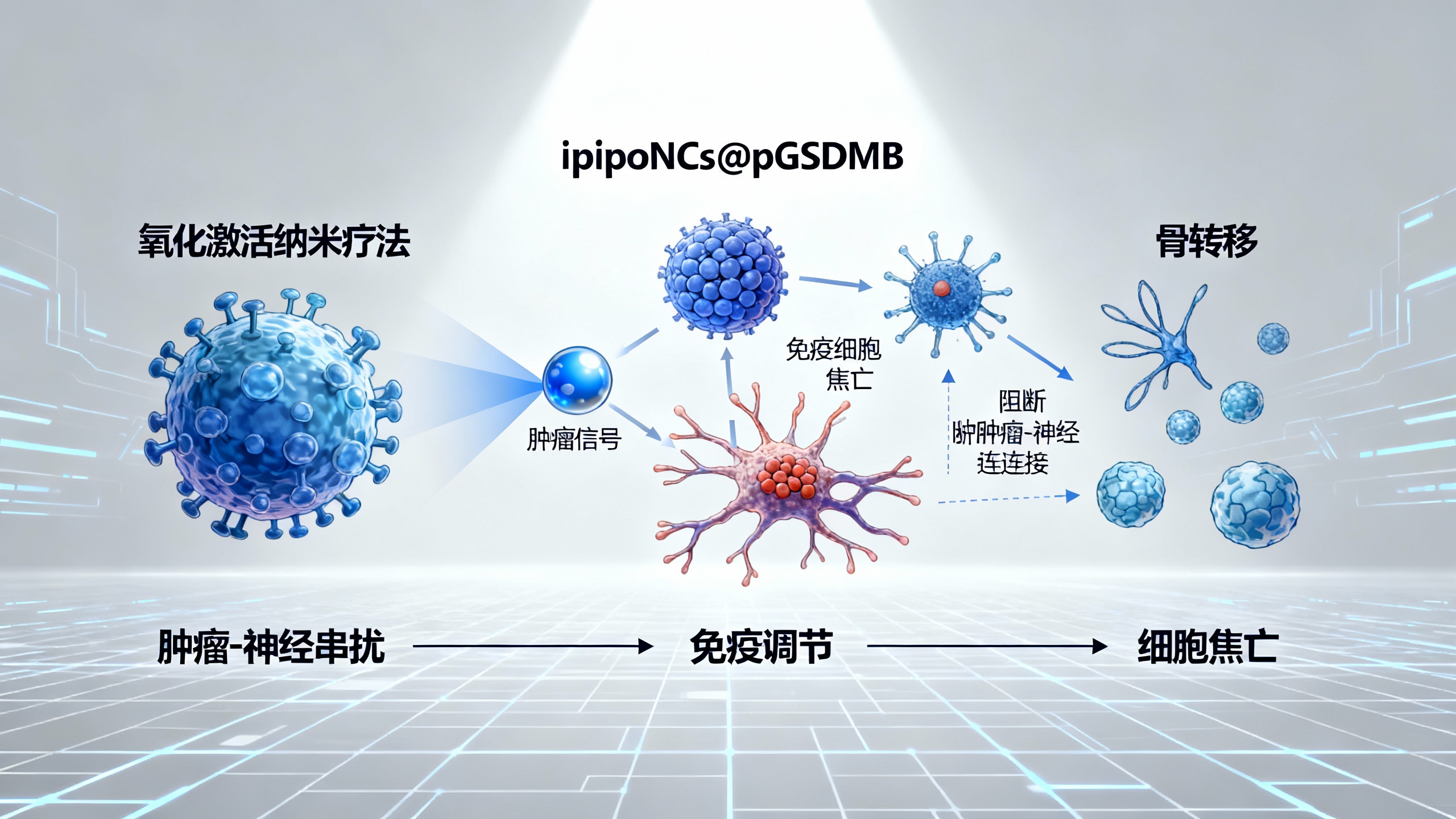
新型纳米疗法:激活氧化反应,增强抗癌免疫、阻断癌细胞与神经“勾结”,对抗骨转移和癌痛
骨转移是晚期癌症的致命表现,超过70%的转移性乳腺癌或前列腺癌患者会受其影响,中位生存期仅2-3年,5年生存率不足10%。现有治疗虽能延缓骨相关事件(如溶骨性破坏、病理性骨折),但无法解决骨微环境中驱动转移进展的复杂动态相互作用,尤其是肿瘤-神经串扰和免疫抑制性肿瘤微环境(TIME)。
为应对这一挑战,研究团队开发了一种活性氧(ROS)响应性脂质体纳米平台(LipoNCs@pGSDMB),共递送聚合物STING激动剂(PSA)和gasdermin B(GSDMB)质粒,以实现双重神经-免疫调节。该纳米疗法在转移性骨 niche 中被肿瘤选择性激活后,可诱导STING驱动的免疫启动和GSDMB介导的细胞焦亡,触发强效抗肿瘤反应。
通过对临床标本的多组学分析,研究发现电压门控钙通道(VGCC)是预后生物标志物。LipoNCs@pGSDMB能恢复肿瘤细胞中VGCC的表达,从而阻断钙依赖性神经信号传导,破坏促转移的肿瘤-神经串扰。在乳腺癌骨转移模型中,该疗法实现了94%的肿瘤抑制、完全的疼痛缓解和有效的骨修复。
机制上,LipoNCs@pGSDMB通过氧化响应性纳米材料工程、免疫调节和神经回路重编程,重塑了TIME:增强树突状细胞(DC)成熟、细胞毒性T淋巴细胞(CTL)浸润,减少调节性T细胞(Treg),建立免疫记忆;同时减少肿瘤内神经浸润,降低背根神经节(DRG)神经元兴奋性,缓解神经病理性疼痛。
该研究建立了一种革新性的神经免疫治疗平台,通过拆解自我强化的转移 niche 并解决其致残后遗症,为骨转移治疗提供了新范式。