科学家发现癌细胞存活的“隐藏开关”
作者: aeks | 发布时间: 2025-12-28 18:05 | 更新时间: 2025-12-28 18:05
学科分类: 生物化学与分子生物学 生物医学工程 肿瘤学 药学
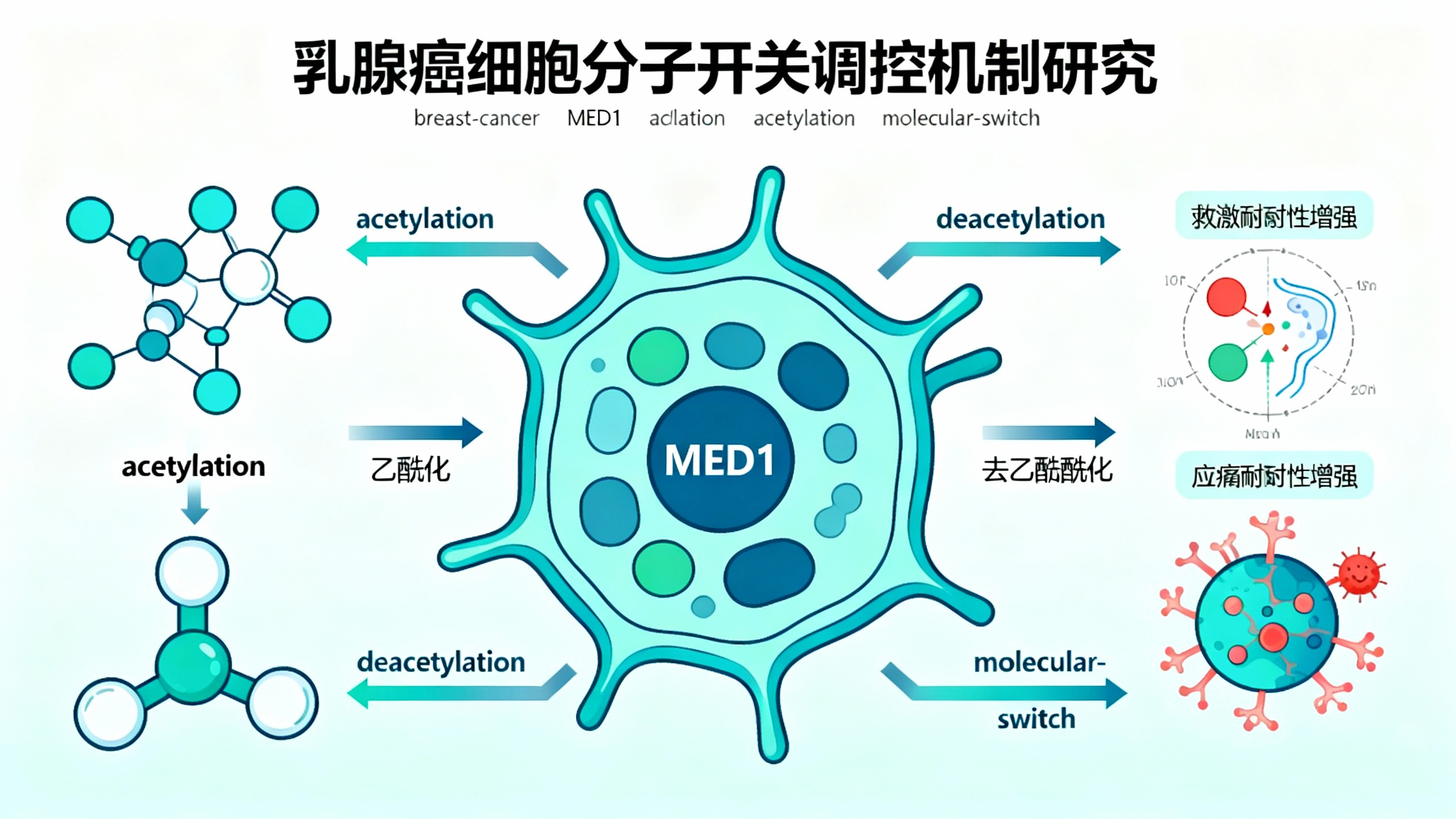
此前,人们一直不清楚癌细胞如何将恶劣的生存环境转化为自身优势。洛克菲勒大学的研究人员推测,答案可能在于了解细胞的转录机制如何感知这些环境条件并改变其活性。他们的研究现已发现,乳腺癌细胞内存在一种分子开关,能够将基因活性重定向,以增强细胞的应激耐受性并促进肿瘤扩张。这项发表在《自然·化学生物学》(Nature Chemical Biology)上的研究,指出了一个潜在的新治疗靶点。
该研究第一作者、洛克菲勒大学生物化学与分子生物学实验室的研究助理林然(Ran Lin)表示:'这种此前未知的转录水平机制有助于癌细胞在恶劣环境中存活,因此靶向这一机制可能会破坏某些癌症赖以生存的关键机制。这再次证明,基础研究能够开辟充满希望的治疗途径。'
实验室主任罗伯特·罗德(Robert Roeder)说:'我们发现,这种分子开关由一种通用转录复合物介导,该复合物通常是所有蛋白质编码基因所必需的。但最出乎意料的是,其单个亚基可被重新利用以实现多种生理功能,包括使癌细胞在高应激环境中存活和生长的功能。'
关键转录因子与MED1的作用
RNA聚合酶II(又称Pol II)是真核细胞中负责转录蛋白质编码基因的酶。罗德最初发现了Pol II,它通常与中介体复合物(一种由30个亚基组成的大型共激活因子)协同作用,启动转录的初始步骤。生成的RNA可通过转录后修饰进行进一步调整,从而影响基因表达。
MED1是中介体复合物的一个重要亚基。在多种细胞类型中,Pol II的转录都需要MED1的参与,包括雌激素受体阳性乳腺癌(ER+ BC)——这是最常见的乳腺癌类型之一。
罗德实验室此前的研究表明,在ER+乳腺癌中,雌激素受体与MED1的相互作用会强烈激活基因表达。在某些情况下,这种相互作用甚至会降低抗癌药物的疗效。这些早期发现使林然质疑,MED1是否也能在癌细胞处于应激状态时支持其存活。
研究MED1与乙酰化
林然首先研究了MED1是否会发生乙酰化。乙酰化是指在蛋白质上添加乙酰基,这种化学修饰会改变蛋白质的功能。科学家们越来越认识到乙酰化对肿瘤生长、癌症扩散和治疗耐药性的影响。
在确认MED1会发生乙酰化后,林然进一步研究了这种修饰在应激条件下如何影响其活性。研究人员将细胞置于多种应激环境中,包括缺氧(氧气缺乏)、氧化应激和热应激。
通过去乙酰化应对应激
研究团队发现,在应激状态下,一种名为SIRT1的蛋白质会从MED1上移除乙酰基。这一过程被称为'去乙酰化',它能使MED1更有效地与Pol II结合,从而增强激活保护性基因的潜力。
为了进一步验证这一机制,研究人员构建了一种缺失六个特定乙酰化位点的MED1变体,使其无法被乙酰化。然后,他们利用CRISPR技术敲除ER+乳腺癌细胞中的天然MED1,并将这种修饰后的蛋白质导入这些细胞。
结果很明确:无论是在应激条件下MED1发生去乙酰化,还是MED1本身无法被乙酰化,结果都是相同的。含有去乙酰化MED1的乳腺癌细胞形成的肿瘤生长更快,且对应激的抵抗力更强。
与肿瘤生长相关的调控开关
林然表示:'我们的研究表明,MED1的乙酰化和去乙酰化充当了一种调控开关,帮助癌细胞在应激时重编程转录,从而支持其存活和生长。在癌症中——尤其是ER+乳腺癌中——这一通路可能被利用或增强,以支持异常的生长和存活。我们希望这些见解能为未来的药物研发提供信息,特别是针对乳腺癌以及可能依赖应激诱导基因重编程的其他恶性肿瘤。'
罗德补充道:'这种MED1调控通路似乎是乙酰化调控转录因子这一更广泛范式的一部分。我们早期关于p53的研究帮助确立了这一原理。持续探索这些基本机制,使我们能够识别出最终可能用于治疗目的的通路。'