免疫治疗期间肠道抗体增多,帮助T细胞更好抑制肿瘤生长
作者: aeks | 发布时间: 2025-11-17 03:01 | 更新时间: 2025-11-17 03:01
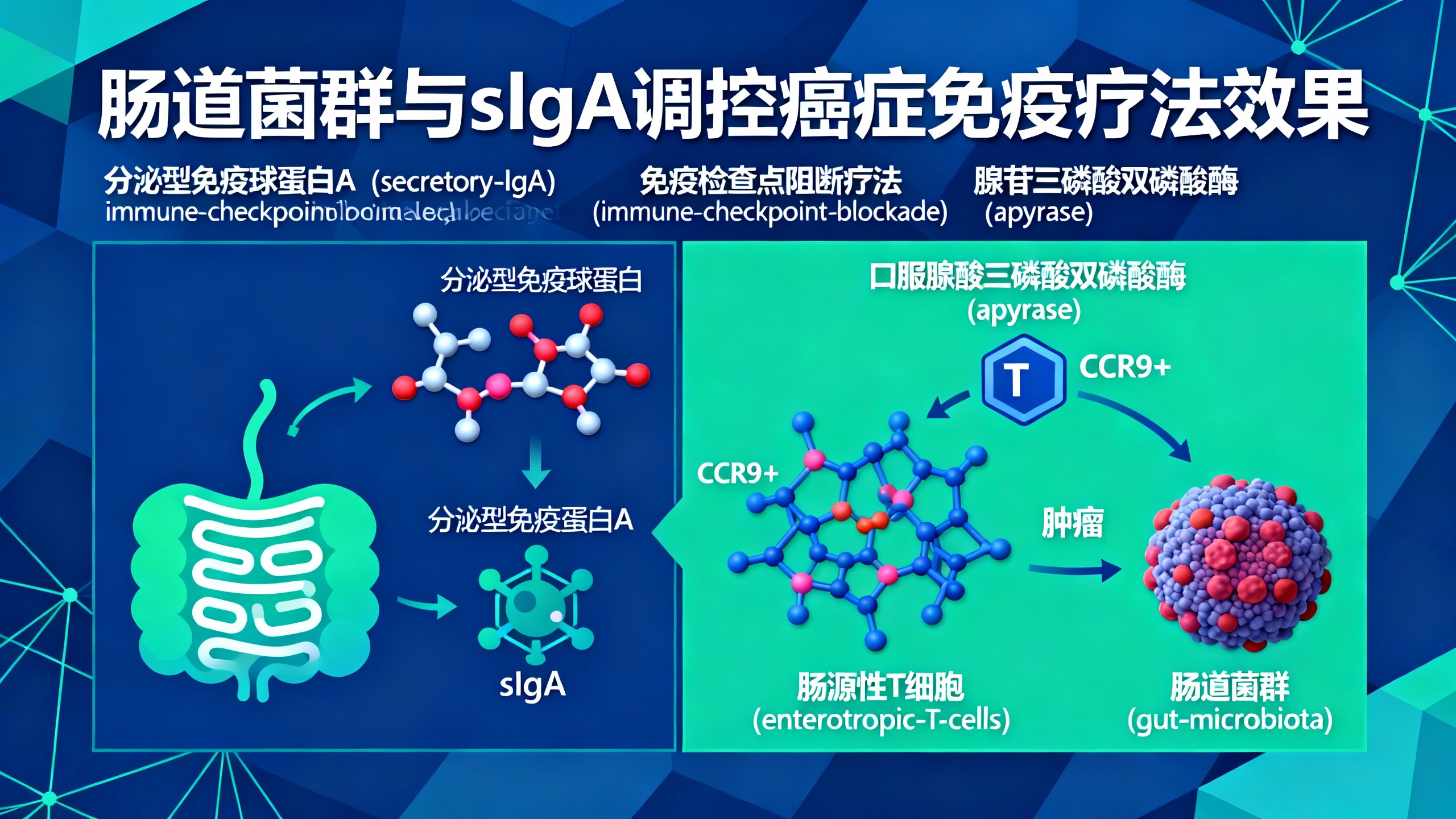
肠道菌群对人体生理至关重要,分泌型免疫球蛋白A(sIgA)可调节其功能。肠道菌群会影响癌症免疫检查点阻断疗法(ICB,一种通过解除免疫系统对肿瘤的抑制来治疗癌症的方法)的疗效,但目前尚不清楚如何改善这一过程。研究发现,肠道菌群释放的细胞外三磷酸腺苷(eATP)会通过刺激派尔集合淋巴结中滤泡辅助性T细胞(TFH细胞)上的P2X7受体,限制sIgA的产生。
本研究表明,口服腺苷三磷酸双磷酸酶(apyrase,一种能分解ATP的酶)可增加sIgA的数量。这种sIgA的增加能纠正ICB治疗引起的肠道病变(如肠道通透性增加、肠绒毛微绒毛减少等),并提高ICB的治疗效果。实验显示,在接受ICB治疗的小鼠中,口服apyrase能显著缩小肿瘤体积、延长生存期,而敲除了IgA基因的小鼠(IgA−/−)接受apyrase治疗后则无此效果,说明sIgA的增加是apyrase增强ICB疗效的关键。
进一步研究发现,apyrase通过增加sIgA,促进了肠道内约氏乳杆菌(Lactobacillus johnsonii)等有益菌的定植。这些细菌能增强肠道CD8+ T细胞的功能(如增加干扰素-γ、肿瘤坏死因子-α等细胞因子的分泌)。同时,apyrase还能激活表达趋化因子受体CCR9的肠源性细胞毒性T细胞,这些T细胞会在趋化因子CCL25的作用下迁移到肿瘤微环境中,发挥抗肿瘤作用。在肿瘤微环境中,这些T细胞表现出更强的效应功能,如分泌颗粒酶B、穿孔素等,从而有效控制肿瘤生长。
此外,对癌症患者样本的分析显示,肿瘤中CCL25的表达水平与ICB治疗响应相关,CCL25高表达的患者往往有更好的预后。这提示,通过调节sIgA和肠道菌群来增强肠源性T细胞的抗肿瘤活性,可能是提高ICB治疗响应率的新策略。