借助“细胞地图”找到调控T细胞发育的关键开关
作者: aeks | 发布时间: 2026-02-05 21:03 | 更新时间: 2026-02-05 21:03
细胞状态是特定细胞类型与环境相互作用产生的一系列细胞表型。在免疫系统中,T细胞具有多种分化状态,尤其是初始T细胞在肿瘤、病毒感染等不同免疫环境中,会分化为功能和迁移模式各异的状态。转录因子(TF)调控细胞状态分化,了解其如何塑造这些状态对设计具有治疗潜力的有益状态至关重要。其中,增强CD8+ T细胞用于肿瘤浸润淋巴细胞(TIL)或嵌合抗原受体(CAR)T细胞的过继细胞转移疗法(ACT)是一个有前景的应用方向。然而,由于CD8+ T细胞状态存在高度异质性,即使功能不同的状态也可能有重叠的转录组,因此识别控制这些状态的转录因子具有挑战性。
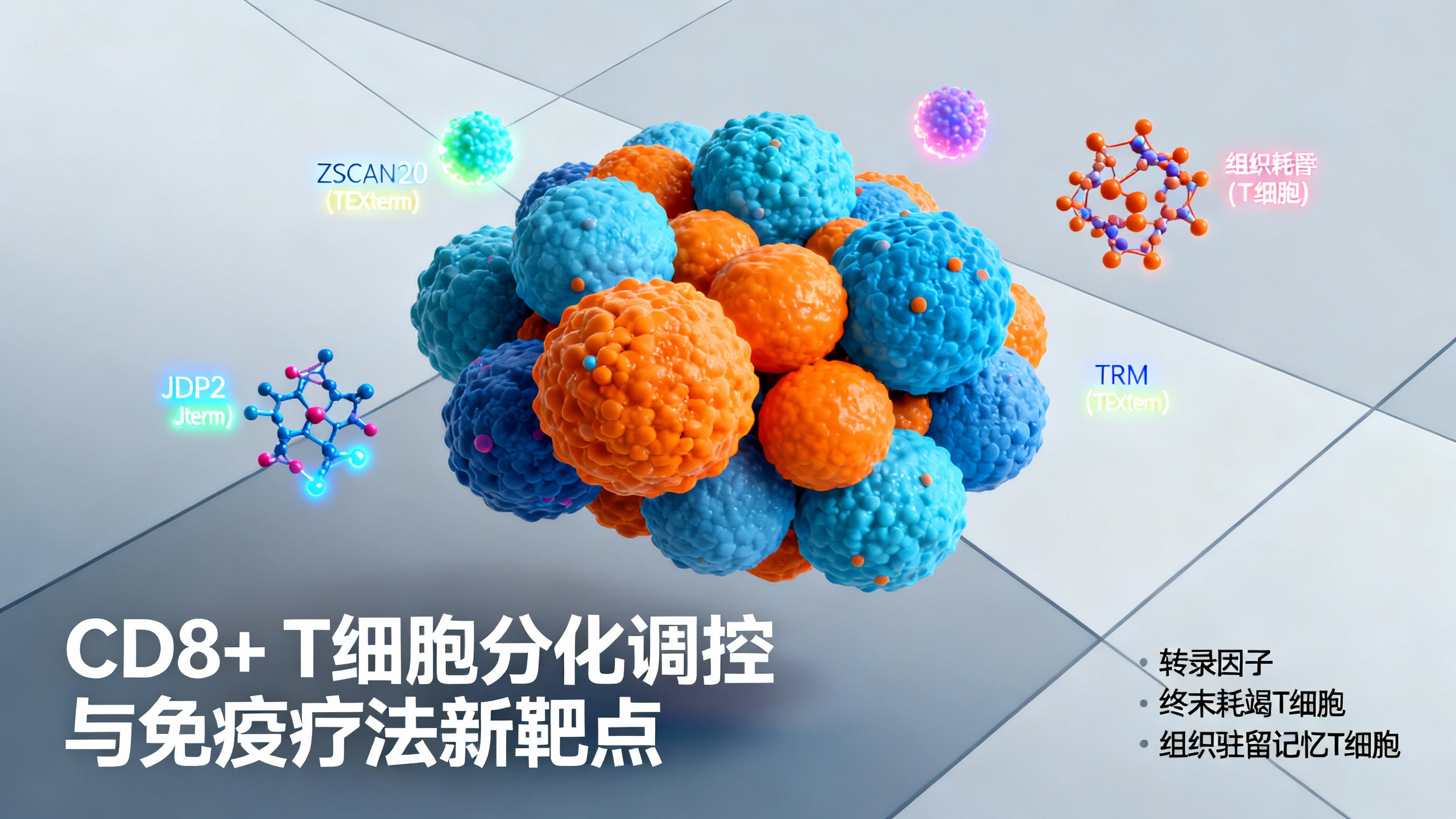
本研究聚焦两种转录组相似但功能相反的状态:具有保护作用的组织驻留记忆T细胞(TRM)和功能失调的终末耗竭T细胞(TEXterm)。研究表明,具有TRM特征的肿瘤浸润淋巴细胞与实体瘤患者的更好生存率相关;而在慢性病毒感染(如HIV)或癌症等持续抗原刺激下,T细胞会逐渐表达多种抑制性受体(如PD1),丧失记忆潜能和效应功能,即T细胞耗竭(TEX),最终形成TEXterm细胞。TEXterm细胞高表达多种抑制性受体(如TIM3、CD101),缺乏效应和增殖能力,对免疫检查点阻断(ICB)反应不佳,其标志物高表达常提示实体瘤预后不良。尽管TEXterm和TRM对癌症结局的功能影响不同,但它们都优先存在于组织中,且转录谱有显著相似性(如均表达BLIMP1、BHLHE40、NR4A2等关键调控转录因子),甚至开放染色质区域高度相关,这使得精准识别能选择性抑制TEXterm发育同时保留TRM的转录因子变得复杂。
研究假设通过系统比较分化过程中的转录因子活性可识别控制CD8+ T细胞选择性分化的关键转录因子。为此,整合9种CD8+ T细胞状态的转录组和染色质可及性数据,开发了多组学图谱,结合Taiji分析 pipeline构建基因调控网络并计算转录因子活性分数(PageRank)。该图谱识别出136个“单状态”转录因子(每个细胞状态特有12-19个)和173个“多状态”转录因子(在多个状态中起关键作用)。针对TEXterm和TRM,进一步筛选出20个TRM单状态转录因子、34个TEXterm单状态转录因子及30个两者共有的多状态转录因子,其中包括新发现的TEXterm单状态转录因子(如Zscan20、Jdp2)、TRM单状态转录因子(如Klf6)以及多状态转录因子(如Hic1、Gfi1)。
通过体内CRISPR筛选结合单细胞RNA测序(in vivo Perturb-seq),在慢性和急性LCMV感染模型中验证了这些转录因子的功能。结果显示,敲除TEXterm单状态转录因子(如Zscan20、Jdp2)可显著减少TEXterm细胞分化,增加效应细胞比例,增强细胞因子产生和病毒清除能力,且不影响TRM形成;而敲除多状态转录因子(如Hic1、Gfi1)则会同时抑制TEXterm和TRM分化。过表达TRM单状态转录因子Klf6可显著促进TRM形成且不加剧终末耗竭。在肿瘤模型中,靶向TEXterm单状态转录因子(如Zscan20)比多状态转录因子(如Hic1)能更有效改善肿瘤控制,其敲除的T细胞在肿瘤中效应标志物表达更高,与ICB联合使用可显著减少肿瘤负荷。
跨物种验证显示,小鼠TEXterm和TRM相关转录因子在人类肿瘤浸润CD8+ T细胞中具有保守性,敲除人T细胞中的ZSCAN20和JDP2可降低抑制性受体表达,增强效应功能。该研究通过解析耗竭与保护性T细胞程序,为更精准的T细胞状态工程化提供了平台,加速了更有效的细胞免疫疗法的合理设计。