肠道菌群帮助免疫细胞灵活作战,有效控制肿瘤
作者: aeks | 发布时间: 2026-01-16 03:02 | 更新时间: 2026-01-16 03:02
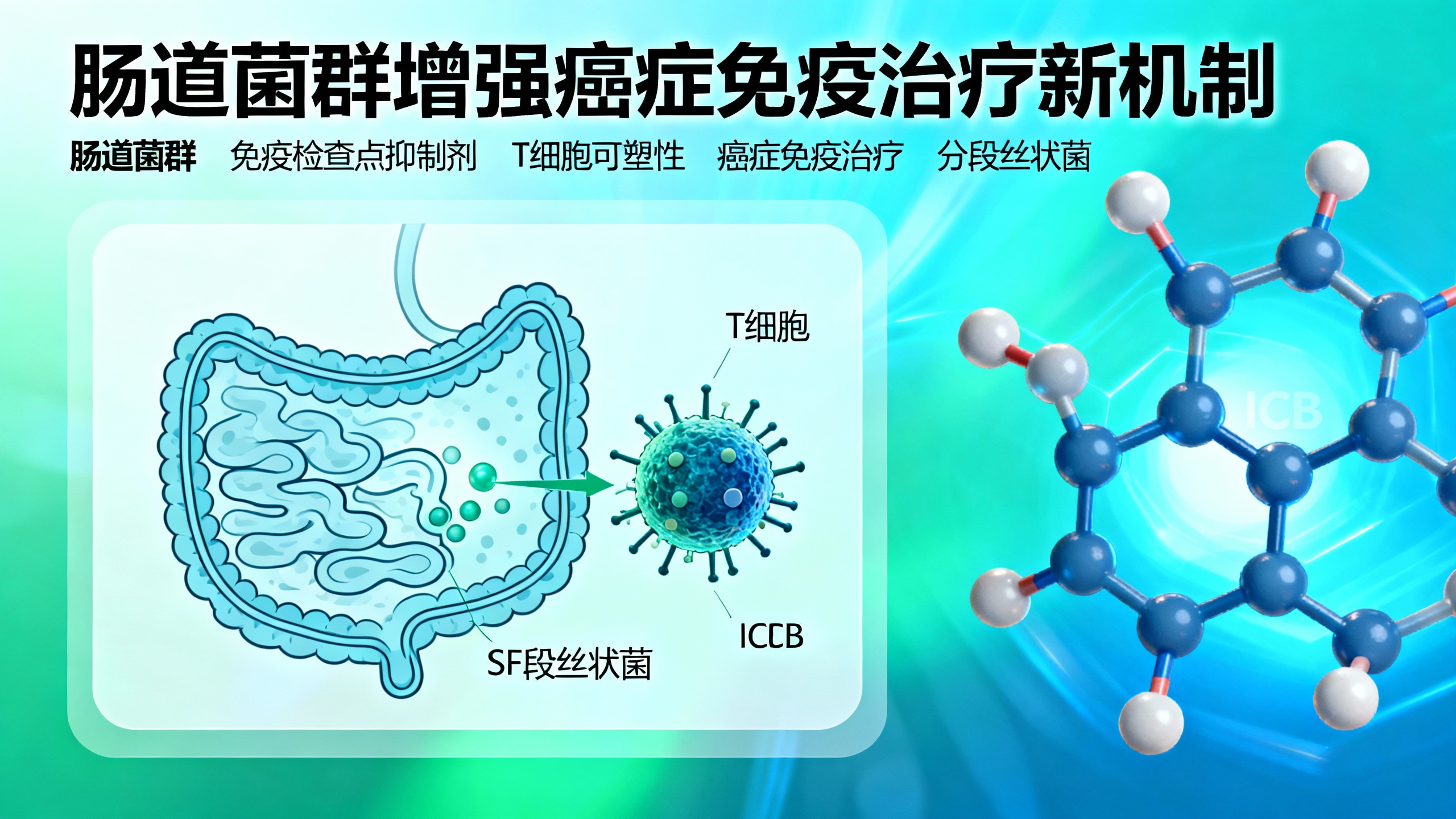
免疫检查点抑制剂(ICB)是一种通过解除T细胞活化的负调控、增强抗肿瘤免疫反应的疗法,对部分癌症患者效果显著,但仍有大量患者对治疗无反应,因此深入理解影响ICB疗效的因素至关重要。肠道菌群(肠道内数万亿微生物的总称)已被证实是免疫功能和癌症免疫治疗反应的关键决定因素,多项研究表明菌群组成与临床反应相关,但其如何影响ICB疗效的机制尚不明确。
本研究以肠道共生菌——分段丝状菌(SFB)为研究对象,SFB能在小肠黏膜固有层(SILP)诱导抗原特异性辅助性T细胞17(Th17)的效应程序。研究通过构建表达SFB抗原的肿瘤模型,探究SFB定植如何影响ICB对远端肿瘤的控制效果。结果发现,只有当小鼠定植SFB时,抗PD-1治疗才能有效抑制表达SFB抗原的黑色素瘤生长。通过T细胞受体(TCR)克隆谱系追踪、命运图谱分析和肽-主要组织相容性复合体(MHC)四聚体染色等技术,研究识别出肿瘤中与SFB相关的Th1样细胞,这些细胞来源于SFB在SILP中诱导的稳态Th17细胞。这些“肠道训练”的前Th17细胞在肿瘤微环境(TME)中产生高水平的促炎细胞因子(如干扰素-γ和肿瘤坏死因子),增强抗原呈递,促进肿瘤浸润性细胞毒性CD8+ T淋巴细胞的招募、扩增和效应功能,从而实现抗PD-1介导的肿瘤控制。
进一步研究显示,条件性清除SFB诱导的IL-17A+ CD4+ T细胞(肿瘤相关Th1样细胞的前体)会消除抗PD-1介导的肿瘤控制,并显著削弱肿瘤微环境中肿瘤特异性CD8+ T细胞的招募和效应功能。此外,研究还对比了另一种肠道菌——肝螺杆菌(H. hepaticus)的作用,发现其虽能诱导肿瘤中的特异性T细胞,但这些细胞多为调节性表型,无法增强ICB疗效。
本研究证实,单一特定肠道共生菌可通过塑造T细胞可塑性来增强PD-1阻断疗法的效果,为通过靶向调节肠道菌群拓宽ICB疗效提供了理论依据和策略方向。