驻留型自然杀伤细胞可抑制人体淋巴组织中的艾滋病病毒感染
作者: aeks | 发布时间: 2026-01-26 15:01 | 更新时间: 2026-01-26 15:01
HIV主要在CD4+ T淋巴细胞中复制,若不治疗会导致艾滋病。尽管抗逆转录病毒疗法(ART)能将病毒载量降至检测不到的水平,但HIV仍是无法治愈的疾病。急性感染期间,HIV迅速扩散到次级淋巴组织,在那里很快建立病毒库,即使接受ART治疗,淋巴组织仍是HIV持续存在的关键“避难所”,这对治愈构成了重大障碍。
自然杀伤(NK)细胞是先天性淋巴细胞,能在无需预先抗原致敏的情况下有效杀死肿瘤细胞和受感染细胞,因此募集功能成熟的NK细胞可能有效控制淋巴组织中的HIV。在非洲绿猴(AGM,猴免疫缺陷病毒SIV的自然宿主)中,病毒感染会诱导次级淋巴组织中终末分化NK细胞的扩增,从而对感染产生强大的局部控制。
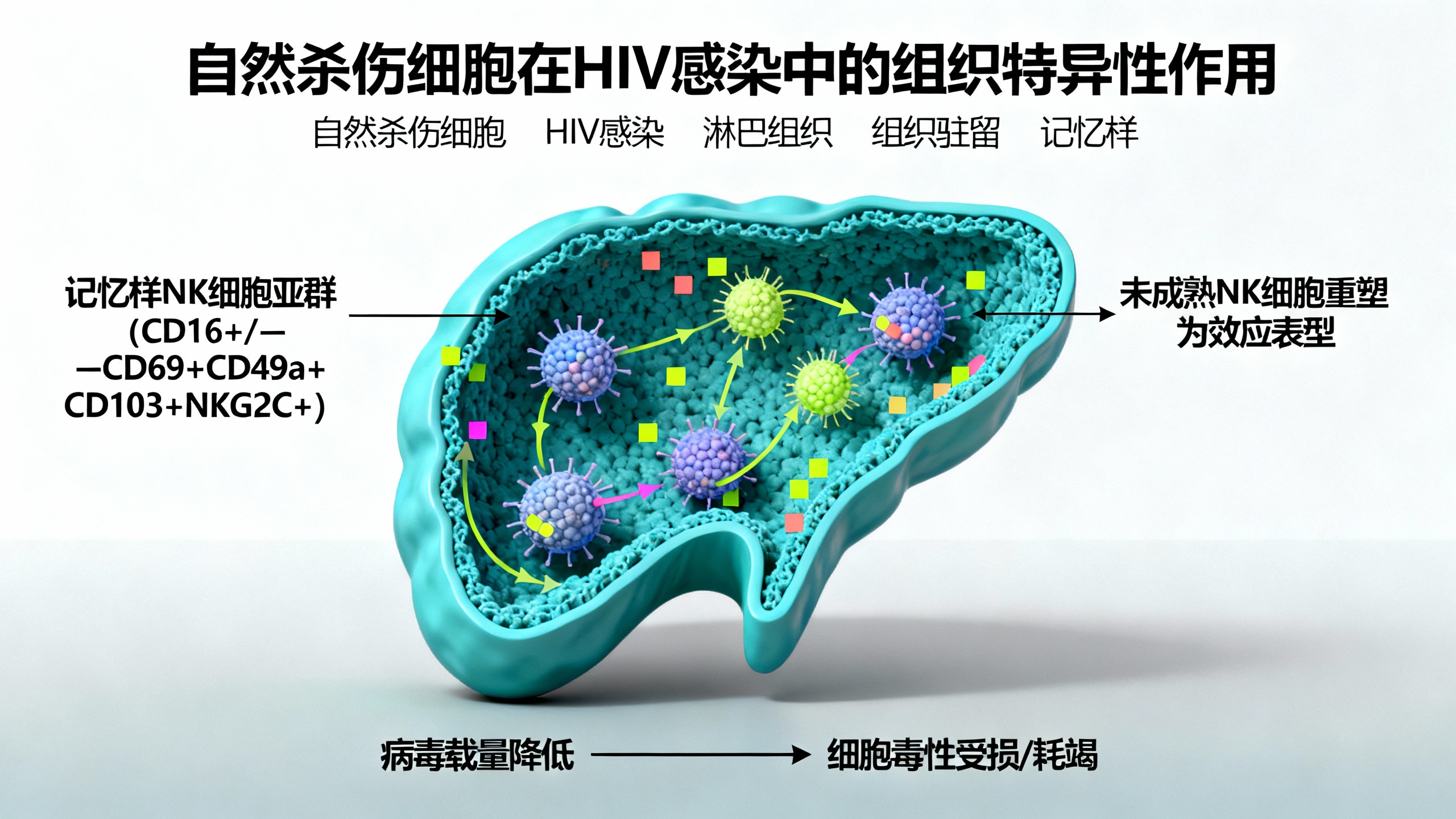
本研究利用离体人扁桃体组织模型,探究了HIV感染早期NK细胞的反应,并发现了具有特殊功能的不同亚群。研究鉴定出一种此前未被描述的记忆样NK细胞群(CD16+/−CD69+CD49a+CD103+NKG2C+),该群与病毒载量降低相关,且富含细胞毒性介质(如颗粒溶素GNLY、穿孔素PRF1、颗粒酶GZMB)、凋亡配体(FASLG、TRAIL)、细胞因子受体(IL2RA、IL2RB等)和趋化分子(CCL3–5、CCR7等)。虽然在组织模拟环境中,这些NK细胞能够清除HIV感染的CD4+ T细胞,但感染后它们的细胞毒性受损,并出现转录层面的耗竭迹象。相反,HIV会驱动未成熟的CD16−CD69+ NK细胞重编程,使其向更具细胞毒性和迁移能力的效应表型转变。
研究还发现,扁桃体NK细胞存在表型异质性。大多数扁桃体CD56+ NK细胞为CD16−(中位数73.1%),CD16+ NK细胞则更易表达组织驻留标志物(CD49a、CD103)和记忆样标志物(KIRs、NKG2C)。功能分析显示,CD49a+ NK细胞(尤其是CD16−亚群)具有较高的脱颗粒和IFN-γ产生能力,而CD49a−细胞在基础状态下已表达高水平CD107a,对刺激的进一步反应有限。细胞外基质成分(如胶原蛋白I和IV)会影响NK细胞功能,CD49a+ NK细胞在胶原蛋白环境中能增强脱颗粒和细胞因子产生。
在HIV感染模型中,表达NKG2C的三阳性(CD69+CD49a+CD103+,TP)NK细胞与较低的HIV感染水平相关,而免疫检查点分子(如PD-1、KLRG1)的表达则与较高的病毒载量相关。功能杀伤实验表明,在3D胶原蛋白凝胶环境中,TP NK细胞对HIV感染细胞的杀伤效果优于悬浮培养。单细胞RNA测序显示,HIV感染会诱导扁桃体NK细胞发生转录组改变,如分化程度较高的抗病毒NK细胞亚群功能受损,而未成熟NK细胞则被激活,表现出更高的反应性。
这些发现揭示了早期HIV感染期间淋巴组织中NK细胞的动态适应,强调组织驻留NK细胞可能是免疫治疗干预的潜在靶点。