新型口服凝胶助力治疗肠道炎症
作者: aeks | 发布时间: 2025-12-14 12:23 | 更新时间: 2025-12-14 12:23
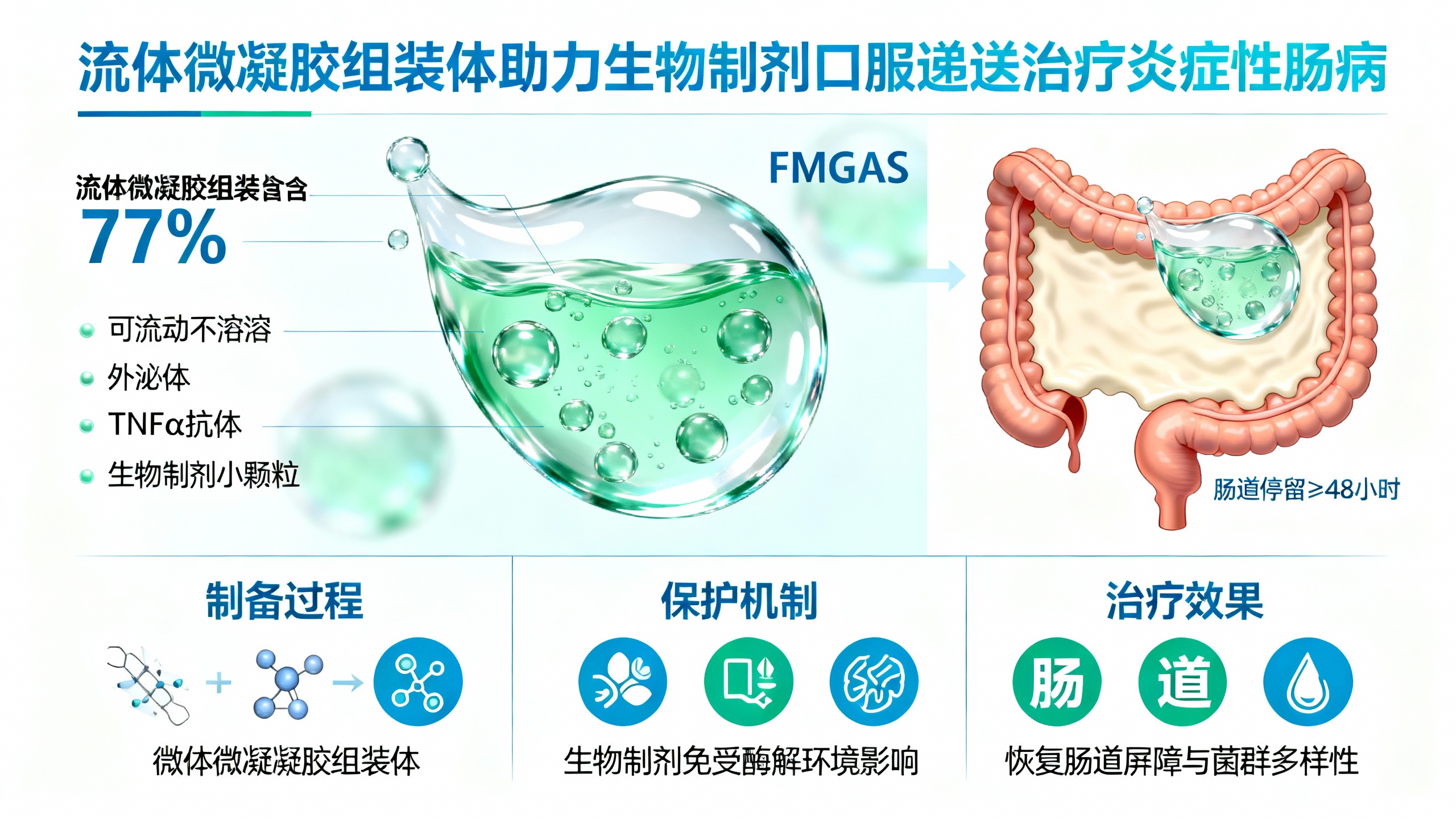
炎症性肠病(IBD)是一种需终身治疗的疾病,生物制剂是其重要治疗手段,但目前主要通过注射给药,存在全身暴露风险和患者依从性差等问题。口服生物药虽为理想方式,却因胃肠道内酶解快、停留时间短、肠道蠕动和腹泻导致药物稀释等问题,疗效受限。
为此,研究团队开发了一种流体微凝胶组装体(FMGAs)。它由核壳结构微凝胶通过表面单宁酸(TAN)的邻苯三酚基团形成多齿氢键组装而成,含水量77%,具有宏观流动性且不与水混溶。与传统固态或半固态微凝胶组装体不同,FMGAs口服后能适应动态胃肠道环境,在肠道表面形成大面积、耐用的物理黏附涂层,停留时间超过48小时。
FMGAs的核心优势在于:一是能高效装载生物制剂(如间充质干细胞外泌体、TNFα抗体),微凝胶间的空隙为其提供保护,抵御胃酸、消化酶等恶劣环境;二是实现生物制剂在肠道病变部位的持续释放。体外实验显示,FMGAs装载的外泌体结构完整,表面标志物(CD63、CD9)保留良好,细胞摄取效率与未处理外泌体相当,且能有效抑制巨噬细胞分泌促炎因子(IL-6、TNFα),促进抗炎因子(IL-10)释放。
在动物模型中,FMGAs表现出显著疗效。在右旋糖酐硫酸钠(DSS)诱导的小鼠溃疡性结肠炎模型中,口服FMGAs-外泌体可减轻体重下降、腹泻和便血,增加结肠长度,降低疾病活动指数(DAI),改善肠道组织炎症(减少炎性浸润、恢复隐窝结构和杯状细胞数量),并调节巨噬细胞极化(减少促炎M1型,增加抗炎M2型),同时恢复肠道紧密连接蛋白(ZO-1)表达。16S rRNA测序显示,FMGAs-外泌体可提高肠道菌群丰富度和多样性,增加乳酸杆菌等有益菌,减少拟杆菌等有害菌,上调菌群免疫和内分泌系统功能。与临床常用药美沙拉嗪相比,FMGAs-外泌体疗效更优。
在7%乙酸诱导的比格犬结肠炎模型中,FMGAs-外泌体同样延长肠道停留时间至48小时,显著保留结肠长度,降低DAI评分,改善内镜下肠道损伤,恢复外周血炎症标志物(白细胞、超敏C反应蛋白)至正常水平,并通过调节巨噬细胞极化和肠道菌群(如增加氨基酸代谢、核苷酸代谢相关通路)促进黏膜愈合,且肝肾功能指标(AST、ALT、肌酐)正常,无全身毒性。
此外,FMGAs对大分子生物制剂具有普适性,装载TNFα抗体时包封率达73%,显著高于未修饰微凝胶(31%),且在小鼠模型中展现出优异的抗炎效果。
综上,FMGAs凭借宏观流动性和水不混溶性,解决了口服生物药易降解、停留短的难题,为炎症性肠病等胃肠道疾病的治疗提供了安全、高效的新型口服递送平台。