一种高效递送药物的新型纳米小泡
作者: aeks | 发布时间: 2025-11-09 20:50 | 更新时间: 2025-11-09 20:50
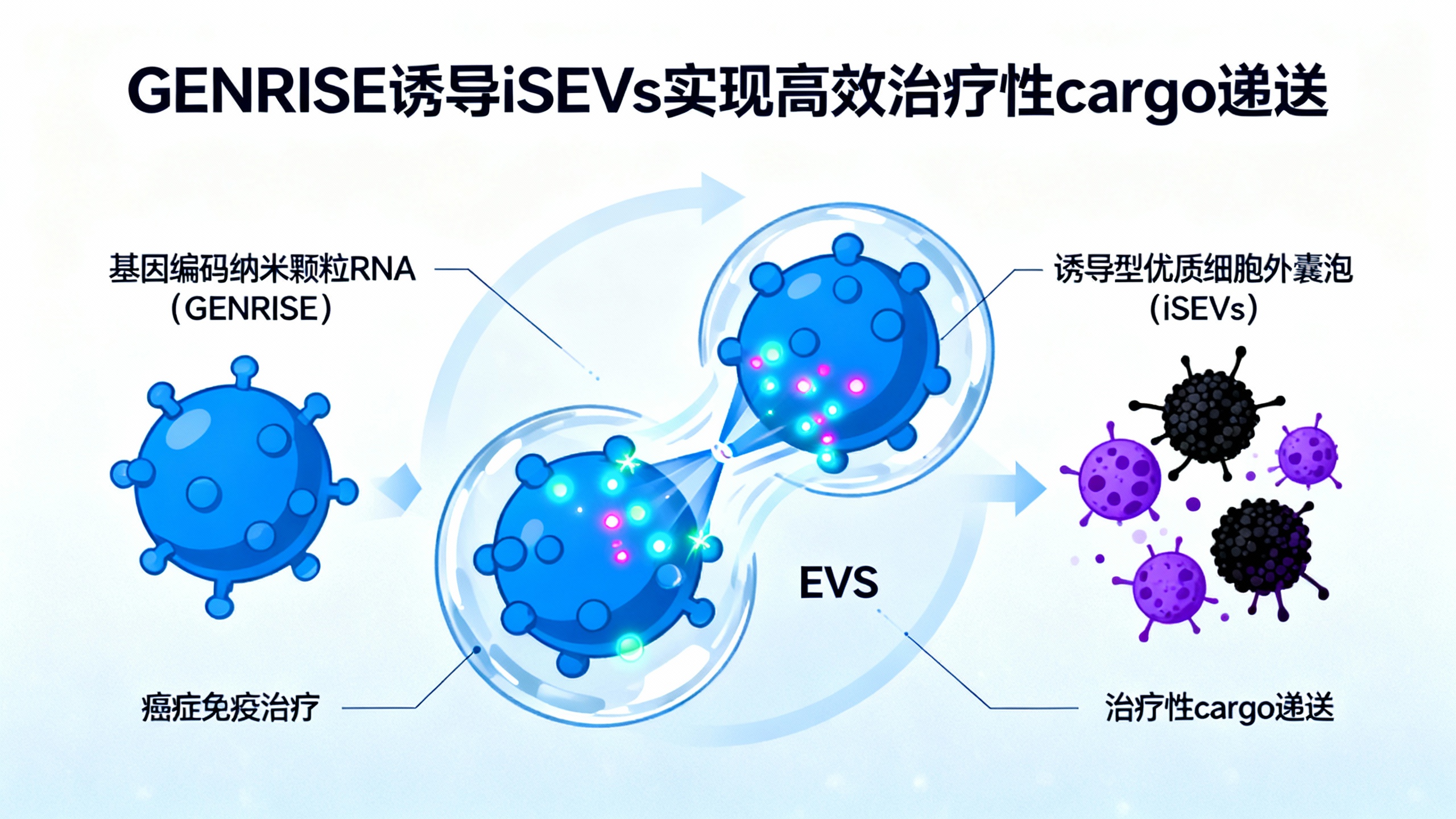
细胞外囊泡(EVs)作为天然来源的活性治疗药物载体,具有巨大应用潜力。然而,其异质性强、可控性差、产量低等问题限制了临床转化。为解决这些挑战,研究团队设计了一种名为 GENRISE(基因编码纳米颗粒 RNA,用于诱导优质 EVs)的无蛋白 mRNA 颗粒样结构。GENRISE 可作为活性翻译海绵和瞬时亚细胞区室,通过局部激活翻译过程,刺激母细胞释放富含外源蛋白的诱导型优质 EVs(iSEVs)。
GENRISE 由长重复 mRNA 组成,通过等温酶促复制从模板质粒 DNA 合成,其内部核糖体进入位点(IRES)序列可启动非帽依赖翻译。进入细胞后,GENRISE 招募胞质核糖体,通过局部解开 mRNA 实现目标蛋白的持续且局限的过表达,引发内质网(ER)应激,促使母细胞释放 iSEVs。这种方式不依赖 RNA 结合蛋白,避免了化学/物理应激对细胞的损伤,也无需复杂的基因工程操作。
研究显示,iSEVs 具有显著优势:产量高,在含血清培养基中,大于 900nm 的 iSEVs 数量较对照组增加约 4000 倍;稳定性好,4°C 可储存 3 周,血清中 24 小时尺寸分布无明显变化;细胞类型独立性强,在 HeLa、MDA-MB-231 等癌细胞及人真皮成纤维细胞(HDF)等原代细胞中均能诱导生成; cargo 装载能力广泛,不仅可包裹过表达蛋白(如 EGFP、TRP2 肽),还能携带金纳米颗粒(AuNPs)等 bulky 纳米结构。通过代谢工程对母细胞进行表面修饰,iSEVs 还可实现量子点(QD)、AuNPs 等功能分子的表面装饰,拓展了应用场景。
机制研究表明,GENRISE 处理后,细胞转录组中翻译相关通路和 ER 应激调控基因显著上调。使用 ER 应激抑制剂(ISRIB)或微囊泡生成抑制剂(泛硫乙胺)可减少 iSEVs 释放,证实 ER 应激和微囊泡生物发生在 iSEVs 生成中起关键作用。
在应用方面,研究团队以黑色素瘤为模型验证了 iSEVs 的免疫治疗效果。将编码黑色素瘤抗原肽 TRP2 的 GENRISE 转入 B16F10 细胞,生成的 TRP2-iSEVs 同时携带 TRP2 肽和全肿瘤抗原。在荷瘤小鼠中,TRP2-iSEVs 可被树突状细胞(DCs)摄取并激活 T 细胞,诱导抗原特异性免疫反应,显著抑制肿瘤生长;与抗 PD-L1 抗体联用可进一步增强疗效,且无明显系统毒性。
该研究开发的 iSEV 平台通过 GENRISE 实现了 cargo 特异性 EVs 的可控生产,解决了传统 EVs 的产量和 cargo 装载难题,为个性化疫苗、靶向药物递送等生物医学应用提供了新思路。
标签: 基因编码纳米颗粒RNA(GENRISE) 治疗性 cargo 递送 癌症免疫治疗 细胞外囊泡(EVs) 诱导型优质细胞外囊泡(iSEVs)