口服“智能探针”帮助肠镜精准切除微小肿瘤并激活免疫治疗
作者: aeks | 发布时间: 2026-01-04 21:04 | 更新时间: 2026-01-04 21:04
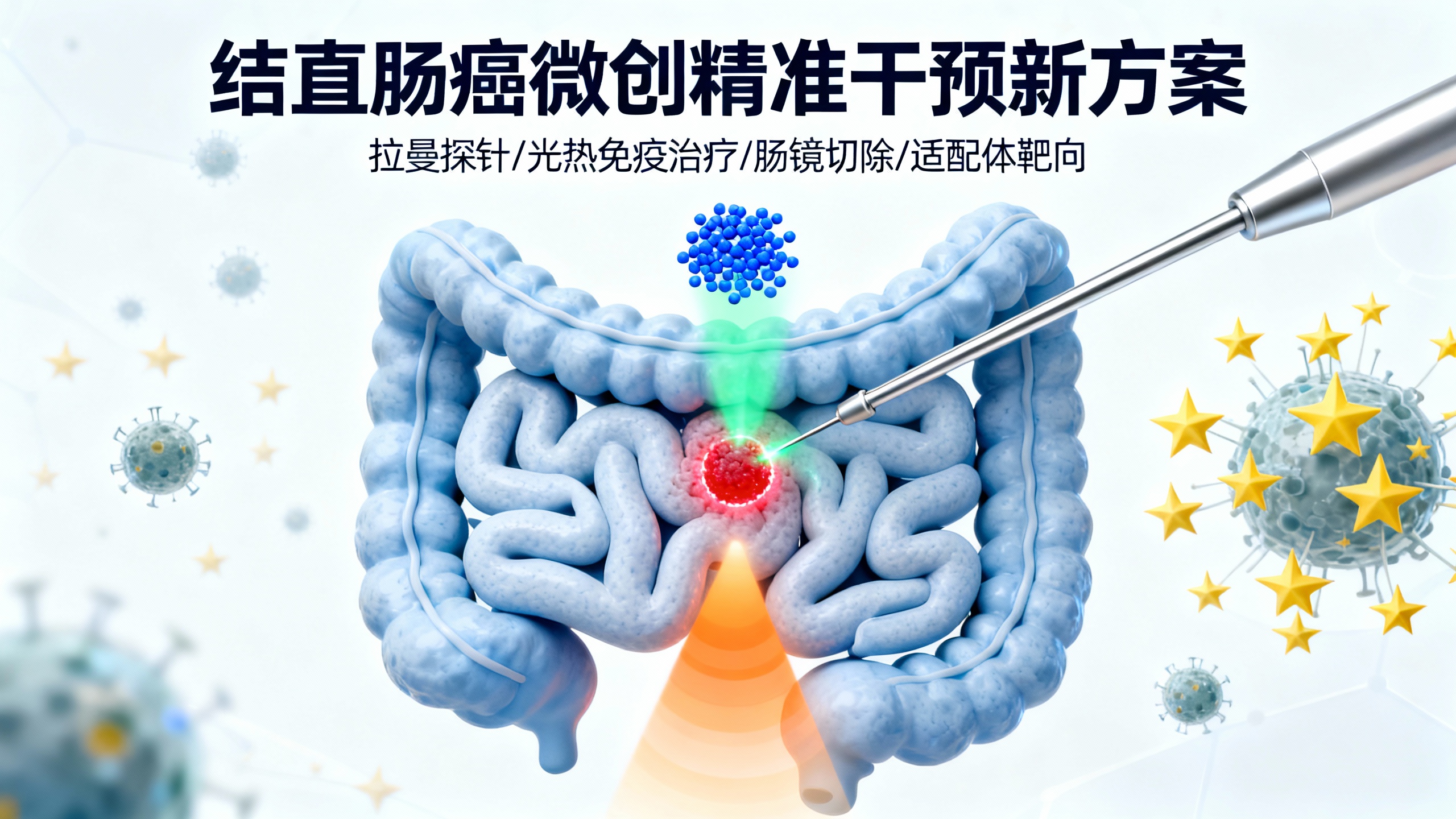
结直肠癌是全球常见恶性肿瘤,早期内镜切除可显著提高生存率,但存在肿瘤边界识别难和残留病灶清除难两大挑战,导致术后复发风险较高。为此,研究团队开发了一种口服适配体修饰的SICTERS拉曼探针(BBT-Apt@CS NPs),用于肠镜引导下的微肿瘤切除和光热免疫治疗。
该探针以堆叠诱导电荷转移增强拉曼散射(SICTERS)分子BBT为核心,表面修饰肿瘤靶向适配体AS1411,外层包裹壳聚糖和海藻酸钠形成肠溶涂层。这种涂层能保护探针通过上消化道,在结肠内缓慢降解,释放内部纳米颗粒。实验表明,探针在模拟胃肠液中稳定性良好,适配体和BBT分子活性不受影响,能特异性识别高表达核仁素的结肠癌细胞(如CT26),对正常细胞(如NCM460)识别率低。
在动物模型中,口服探针24小时后,肿瘤区域拉曼信号(894 cm⁻¹特征峰)显著强于正常组织,能清晰勾勒肿瘤边界,甚至检测到微小转移灶。在自发肿瘤模型(APCMin/+小鼠)中也实现了高灵敏度检测,且通过拉曼内镜可在体识别肿瘤。此外,BBT-Apt NPs具有优异光热性能,808nm激光照射下肿瘤部位温度可达50°C,能有效消融残留病灶。
光热治疗后,肿瘤细胞释放抗原,促进树突状细胞成熟和T细胞增殖(CD4⁺、CD8⁺ T细胞及记忆T细胞数量增加),诱导免疫记忆。在肿瘤再挑战模型中,接受光热治疗的小鼠无肿瘤复发。生物安全性评估显示,探针主要通过粪便排泄,对主要器官无损伤,血液生化指标正常。
该研究通过将分子诊断与实时手术引导相结合,有望提高早期结直肠癌检出率,降低术后复发风险,为结直肠癌微创精准诊疗提供新思路。尽管目前在小鼠模型中验证,未来需优化内镜下切除操作及成像时间以推动临床转化。