用新型中性脂质替代胆固醇和PEG脂质,实现mRNA精准靶向脾脏
作者: aeks | 发布时间: 2025-10-11 20:46 | 更新时间: 2025-10-11 20:46
学科分类: 化学工程与技术 材料科学与工程 生物医学工程 药学
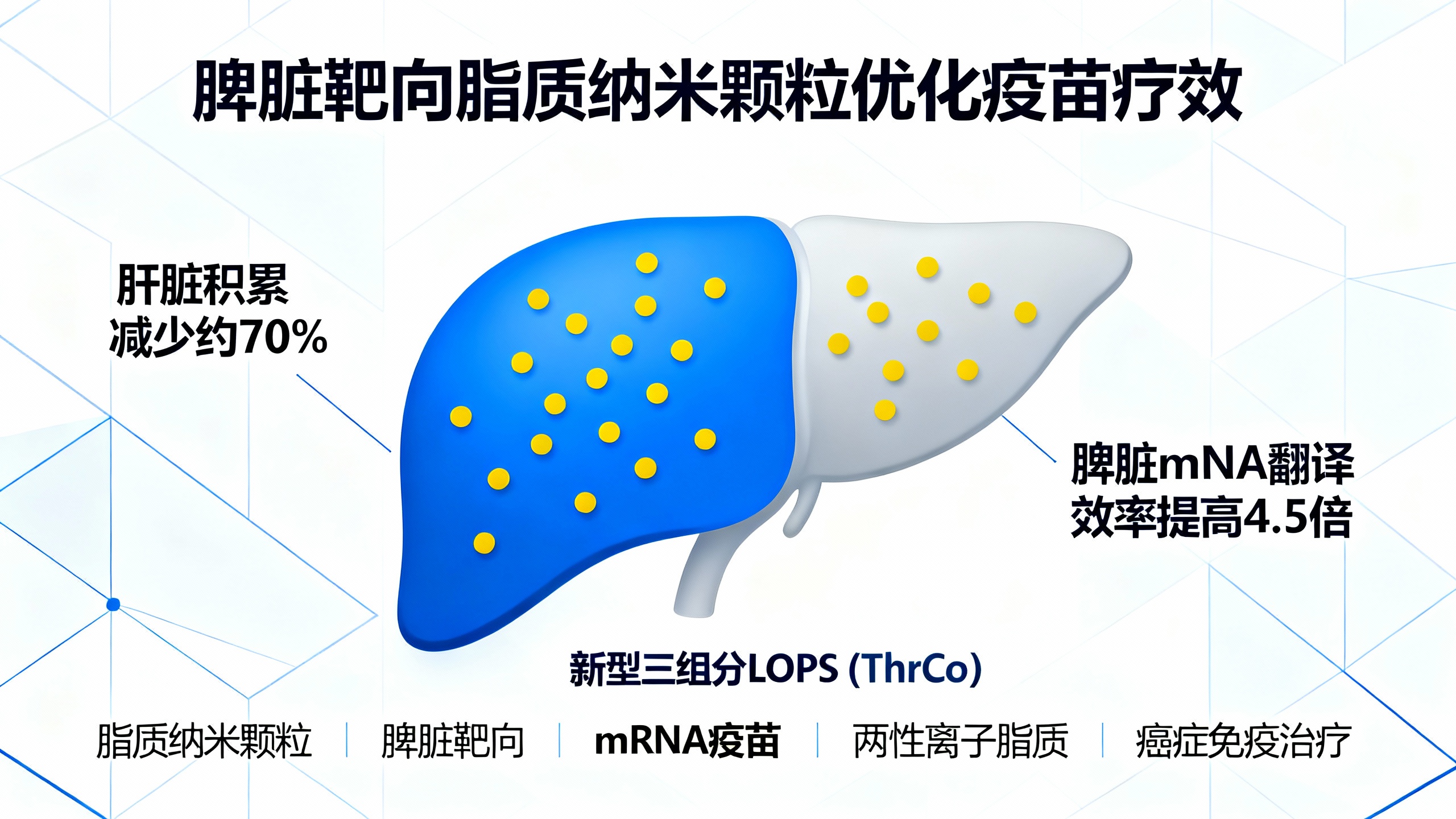
脾脏作为人体最大的次级淋巴器官,富含抗原呈递细胞(APC)和淋巴细胞,近年来被认为是疫苗开发的关键靶点。然而,目前广泛使用的脂质纳米颗粒(LNPs)在静脉注射后大多会聚集在肝脏,导致疫苗难以有效作用于脾脏等免疫器官。这主要是因为传统LNP中含有胆固醇和聚乙二醇修饰的脂质(PEG化脂质),前者促进与肝细胞结合,后者可能引发免疫反应,影响重复给药效果。
为解决这一问题,研究人员开发了一种新型三组分LNP,称为ThrCo LNP。它去除了传统配方中的胆固醇和PEG化脂质,取而代之的是一种名为吡啶羧基甜菜碱(PyCB)的两性离子可电离脂质。这种新设计不仅简化了结构,还带来了多重优势。首先,PyCB脂质增强了LNP表面的亲水性,弥补了因去除胆固醇可能导致的结构不稳定,从而维持高效的mRNA封装能力。其次,由于不含胆固醇,ThrCo LNP不易与脂蛋白结合,因此减少了向肝脏的分布,更多地进入脾脏,实现了脾脏特异性的mRNA翻译。
此外,PyCB形成的两性离子表面能显著减少血液中蛋白质的非特异性吸附,避免了PEG引发的“加速血清除效应”(ABC效应),使得多次注射仍能保持良好的疗效。更重要的是,PyCB在酸性环境(如细胞内的内体)中可迅速质子化,带正电荷,有助于LNP逃逸出内体,将mRNA顺利释放到细胞质中进行翻译。
实验结果显示,与辉瑞-BioNTech的BNT162b2 LNP相比,ThrCo LNP在脾脏中的mRNA翻译效率提高了4.5倍;相较于此前报道的其他脾脏靶向LNP,效率提升更是超过40倍。这些mRNA主要在脾脏的树突状细胞和巨噬细胞等抗原呈递细胞中表达,说明疫苗能精准激活关键免疫细胞。
在小鼠模型中,使用ThrCo LNP作为载体的癌症疫苗显著增强了抗原特异性杀伤性T细胞的活化,有效抑制了肿瘤生长、肺转移和复发。即使多次接种,其效果也没有明显下降,显示出良好的重复给药性能。安全性测试也表明,ThrCo LNP对肝脏的毒性更低,生物相容性良好。
这项研究突破了传统LNP必须包含四种成分的设计思路,证明胆固醇和PEG化脂质并非不可或缺。通过巧妙的化学设计,ThrCo LNP实现了更精准的脾脏靶向递送,为开发高效癌症疫苗和其他免疫疗法提供了新平台。未来,该技术有望应用于个性化癌症疫苗、传染病防治等领域,推动mRNA疗法向更安全、更有效的方向发展。